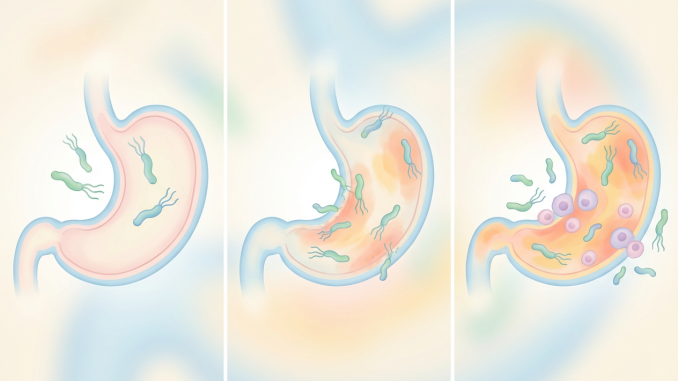
آنچه در این مطلب خواهید خواند
- هلیکوباکتر پیلوری چیست؟
- آیا هلیکوباکتر پیلوری باعث سرطان یا سایر بیماریها میشود؟
- چه شواهدی وجود دارد که نشان میدهد هلیکوباکتر پیلوری باعث سرطان معده میشود؟
- سرطانهای مرتبط با عفونت مزمن هلیکوباکتر پیلوری چقدر شایع هستند ؟
- چه شواهدی وجود دارد که نشان میدهد هلیکوباکتر پیلوری ممکن است خطر ابتلا به برخی سرطانها را کاهش دهد؟
- چگونه ممکن است عفونت هلیکوباکتر پیلوری خطر ابتلا به برخی سرطانها را کاهش دهد اما خطر ابتلا به برخی دیگر از سرطانها را افزایش دهد؟
- چه عواملی احتمال مضر بودن عفونتهای هلیکوباکتر پیلوری را افزایش میدهند؟
- آیا درمان عفونت هلیکوباکتر پیلوری خطر ابتلا به سرطان معده را کاهش میدهد؟
- چه کسی باید برای عفونت هلیکوباکتر پیلوری آزمایش و درمان شود ؟
هلیکوباکتر پیلوری چیست؟
هلیکوباکتر پیلوری ( H. pylori ) یک باکتری مارپیچی شکل استکه در لایه مخاطی پوشاننده داخل معده انسان رشد میکند. اگرچه بسیاری از باکتریها نمیتوانند در محیط اسیدی معده زنده بمانند، H. pylori قادر است اسیدیته محیط محلی خود را در معده خنثی کند، هرچند نمیتواند اسید کل معده را خنثی کند. این خنثیسازی موضعی به بقای باکتری کمک میکند.
راه دیگری که هلیکوباکتر پیلوری در محیط اسیدی معده زنده میماند، نفوذ به لایه مخاطی و اتصال به سلولهایی است که سطح داخلی آن را میپوشانند. این امر همچنین به آن کمک میکند تا از تخریب ایمنی جلوگیری کند، زیرا اگرچه سلولهای ایمنی که به طور معمول باکتریهای مهاجم را تشخیص داده و به آنها حمله میکنند، در نزدیکی محلهای عفونت هلیکوباکتر پیلوری تجمع مییابند، اما قادر به رسیدن به پوشش معده نیستند.
هلیکوباکتر پیلوری همچنین با پاسخهای ایمنی موضعی تداخل میکند و آنها را در از بین بردن این باکتری بیاثر میسازد (2،1).
عفونت با هلیکوباکتر پیلوری، به ویژه در کشورهای کمدرآمد و متوسط، شایع است. مراکز کنترل و پیشگیری از بیماریها تخمین میزنند که حدود دو سوم جمعیت جهان این باکتری را در بدن خود دارند (3).
هلیکوباکتر پیلوری عمدتاً از طریق تماس دهانی با مدفوع (مدفوع-دهانی)، بزاق (دهانی-دهانی) یا استفراغ (معده ای-دهانی) از فردی به فرد دیگر منتقل میشود (4). در بیشتر جمعیتها، این باکتری برای اولین بار در دوران کودکی به دست میآید. احتمال ابتلا به عفونت در کودکانی که در فقر، در شرایط شلوغ و در مناطقی با بهداشت ضعیف زندگی میکنند، بیشتر است.
آیا هلیکوباکتر پیلوری باعث سرطان یا سایر بیماریها میشود؟
بله. اگرچه عفونت هلیکوباکتر پیلوری به خودی خود باعث بیماری نمیشود، اما عفونت مزمن در اکثر افراد باعث التهاب طولانی مدت در معده (به نام گاستریت غیر آتروفیک) میشود. این التهاب میتواند منجر به چندین بیماری احتمالی، از جمله گاستریت آتروفیک (نازک شدن پوشش معده ناشی از التهاب طولانی مدت) و انواع خاصی از سرطان معده، به ویژه آدنوکارسینوم معده و لنفوم بافت لنفاوی مرتبط با مخاط معده (MALT) ، که نوع نادری از لنفوم غیر هوچکین است، شود.
به دلیل نقش هلیکوباکتر پیلوری در ایجاد سرطان معده، در سال 1994 توسط آژانس بینالمللی تحقیقات سرطان سازمان بهداشت جهانی (5) به عنوان یک ماده سرطانزای انسانی یا عامل ایجادکننده سرطان طبقهبندی شد. در سال 2021، پانزدهمین گزارش برنامه ملی سمشناسی در مورد مواد سرطانزا، عفونت مزمن با هلیکوباکتر پیلوری را به فهرست موادی که شناخته شده یا به طور منطقی پیشبینی میشود باعث ایجاد سرطان در انسان میشوند، اضافه کرد.
هنوز مشخص نیست که آیا عفونت مزمن هلیکوباکتر پیلوری با افزایش خطر ابتلا به سایر سرطانها مرتبط است یا خیر. اگرچه برخی مطالعات ارتباط احتمالی بین عفونت هلیکوباکتر پیلوری و افزایش خطر ابتلا به سرطان پانکراس را نشان دادهاند، اما یک متاآنالیز در سال 2023 از مطالعات مشاهدهای، شواهد کافی برای حمایت از چنین ارتباطی را نشان نداد (6). شواهد فزایندهای حاکی از ارتباط بین عفونت هلیکوباکتر پیلوری و افزایش خطر ابتلا به سرطان روده بزرگ است (7-9)
با این حال، عفونت با هلیکوباکتر پیلوری با کاهش خطر ابتلا به آدنوکارسینوم مری (نوعی سرطان مری) و بیماری رفلاکس معده به مری، نیز مرتبط است.
عفونت مزمن هلیکوباکتر پیلوری همچنین میتواند باعث زخمهای گوارشی (زخم معده و قسمت فوقانی روده کوچک) شود.
چه شواهدی وجود دارد که نشان میدهد هلیکوباکتر پیلوری باعث سرطان معده میشود؟
بسیاری از مطالعات شواهد محکمی ارائه دادهاند که عفونت مزمن هلیکوباکتر پیلوری باعث آدنوکارسینوم معده و لنفوم MALT معده میشود.
- آدنوکارسینوم معده: مطالعات اپیدمیولوژیک نشان دادهاند افرادی که عفونتهای مزمن هلیکوباکتر پیلوری دارند، خطر بیشتری برای ابتلا به آدنوکارسینوم معده غیرکاردیا دارند- یعنی سرطان در قسمت اصلی معده، به جز قسمتی که به مری نزدیکتر است ( 10-17).
مطالعات اپیدمیولوژیک همچنین نشان دادهاند که در مناطق جغرافیایی که سرطان معده شایع است، به ویژه در آسیا، افراد مبتلا به عفونتهای مزمن هلیکوباکتر پیلوری خطر بیشتری برای ابتلا به سرطان کاردیا معده دارند – یعنی سرطان در قسمتی از معده که به مری نزدیکتر است (18، 19).
علاوه بر این، مطالعات نشان دادهاند که درمان برای ریشهکنی عفونت هلیکوباکتر پیلوری، خطر ابتلا به سرطان معده را در افراد بدون علامت (20)، در افرادی که به دلیل سابقه خانوادگی در معرض خطر بیشتری هستند (21) و در افرادی که برای سرطان معده اولیه جراحی شدهاند (22) کاهش میدهد.
- لنفوم MALT معده: تقریباً همه بیماران مبتلا به لنفوم MALT معده علائم عفونت H. pylori را نشان میدهند و خطر ابتلا به این سرطان در افراد آلوده به طور قابل توجهی بیشتر از افراد غیر آلوده است (23، 24).
قویترین شواهد مربوط به ارتباط عفونت H. pylori با لنفوم MALT معده از مطالعاتی حاصل میشود که نشان میدهد وقتی افراد مبتلا به لنفوم MALT معده با آنتیبیوتیکها برای از بین بردن H. pylori درمان میشوند، تومورهای آنها کوچک میشود (25، 26).
سرطانهای مرتبط با عفونت مزمن هلیکوباکتر پیلوری چقدر شایع هستند ؟
در سطح جهان، سرطان معده پنجمین سرطان شایع است (29-27). این سرطان چهارمین علت شایع مرگ و میر ناشی از سرطان در جهان است که در سال 2020 حدود 769000 نفر را به کام مرگ کشانده است (28).
میزان بروز سرطان معده در بیشتر نقاط جهان رو به کاهش است (30، 31). کاهش میزان بروز سرطان معده عمدتاً در بین افراد بالای 64 سال و برای سرطان معده غیرکاردیا است (31). در سراسر جهان، میزان بروز سرطان معده کاردیا، که زمانی بسیار نادر بود، در دهههای اخیر افزایش یافته است (31، 33).
اکثر موارد آدنوکارسینوم معده و لنفوم MALT معده به عفونت H. pylori نسبت داده میشوند (35).
چه شواهدی وجود دارد که نشان میدهد هلیکوباکتر پیلوری ممکن است خطر ابتلا به برخی سرطانها را کاهش دهد؟
مطالعات اپیدمیولوژیک متعدد، کاهش خطر ابتلا به آدنوکارسینوم مری (اما نه کارسینوم سلول سنگفرشی مری، نوع اصلی دیگر سرطان مری) را در افراد آلوده به هلیکوباکتر پیلوری نشان دادهاند (36-38).
برای مثال، در مطالعات موردی-شاهدی بزرگی که در سوئد و استرالیا انجام شد، عفونت هلیکوباکتر پیلوری به شدت با کاهش خطر ابتلا به آدنوکارسینوم مری مرتبط بود (39، 40).
شواهد تأییدکنندهی نقش عفونت هلیکوباکتر پیلوری در کاهش خطر ابتلا به آدنوکارسینوم مری از این یافته ناشی میشود که میزان ابتلا به این سرطان در چندین کشور غربی طی قرن گذشته به طور چشمگیری افزایش یافته است، زیرا میزان عفونت هلیکوباکتر پیلوری با بهبود بهداشت و استفادهی گسترده از آنتیبیوتیکها کاهش یافته است.
چگونه ممکن است عفونت هلیکوباکتر پیلوری خطر ابتلا به برخی سرطانها را کاهش دهد اما خطر ابتلا به برخی دیگر از سرطانها را افزایش دهد؟
اگرچه به طور قطعی مشخص نیست که چگونه عفونت هلیکوباکتر پیلوری باعث سرطان معده میشود، برخی محققان حدس میزنند که وجود طولانی مدت یک پاسخ التهابی ، سلولهای پوشش معده را مستعد تبدیل شدن به سرطان میکند (41). این ایده با این یافته پشتیبانی میشود که افزایش بیان یک سیتوکین واحد (اینترلوکین-1-بتا) در معده موشهای تراریخته باعث التهاب و سرطان معده پراکنده میشود (42). افزایش گردش سلولی ناشی از آسیب سلولی مداوم میتواند احتمال ایجاد جهشهای مضر در سلولها را افزایش دهد.
کاهش خطر ابتلا به سرطان مری در افراد آلوده به هلیکوباکتر پیلوری ممکن است به کاهش اسیدیته معده مربوط باشد که اغلب پس از دههها کلونیزاسیون هلیکوباکتر پیلوری مشاهده میشود (15). این کاهش، رفلاکس اسید به مری را کاهش میدهد ، که یک عامل خطر اصلی برای آدنوکارسینومهایی است که مری را تحت تأثیر قرار میدهند.
چه عواملی احتمال مضر بودن عفونتهای هلیکوباکتر پیلوری را افزایش میدهند؟
عوامل متعددی بر احتمال ابتلا به سرطان ناشی از عفونت هلیکوباکتر پیلوری تأثیر میگذارند. برخی از این عوامل، ویژگیهای خود باکتری هستند. به عنوان مثال، برخی از سویههای هلیکوباکتر پیلوری سمی به نام CagA تولید میکنند که به محل اتصال سلولهای پوشش معده تزریق میشود. CagA پس از ورود به سلولها، میتواند با از بین بردن کنترلهای رشد سلول و افزایش تحرک سلول، باعث سرطانی شدن آنها شود (43). قرار گرفتن طولانی مدت سلولها در معرض این سم باعث التهاب مزمن میشود. مطالعات اپیدمیولوژی نشان میدهد که سویههای مثبت CagA ارتباط قویتری با سرطان معده غیرکاردیا نسبت به سویههای منفی CagA دارند (44).
برخی شواهد همچنین نشان میدهند که برخی از عوامل سبک زندگی ممکن است خطر ابتلا به سرطان معده ناشی از هلیکوباکتر پیلوری را تغییر دهند. به عنوان مثال، افراد آلوده به هلیکوباکتر پیلوری که سیگار میکشند، در مقایسه با افراد آلوده به هلیکوباکتر پیلوری که سیگار نمیکشند، خطر ابتلا به سرطان معده بیشتری دارند (45). همچنین، مصرف زیاد نمک و گوشت فرآوری شده با افزایش خطر ابتلا به سرطان معده مرتبط است (29)، احتمالاً با افزایش خطر اینکه هلیکوباکتر پیلوری در معده ساکن شود یا CagA وارد سلولهای معده شود (46، 47).
آیا درمان عفونت هلیکوباکتر پیلوری خطر ابتلا به سرطان معده را کاهش میدهد؟
بله. دادههای پیگیری طولانیمدت از یک کارآزمایی بالینی تصادفی که در شاندونگ چین – منطقهای که میزان سرطان معده در آن بسیار بالاست – انجام شد، نشان داد که 2 هفته درمان با آنتیبیوتیک برای ریشهکنی هلیکوباکتر پیلوری، میزان بروز سرطان معده را در طول 22 سال پیگیری پس از درمان، تقریباً 50٪ کاهش داده است (20). مطالعات دیگر در جمعیتهای آسیایی نیز به طور مشابه نشان دادهاند که ریشهکنی هلیکوباکتر پیلوری، میزان بروز سرطان معده را در افراد سالم و بدون علامت آلوده کاهش میدهد (48،49).
یک کارآزمایی بالینی تصادفی دیگر که روی بیمارانی که برای سرطان معده در مراحل اولیه تحت عمل جراحی قرار گرفته بودند، انجام شد، نشان داد که احتمال ابتلا به ضایعات اضافی سرطان معده (به نام سرطان معده متاکرونوس) در افرادی که تحت درمان ریشهکنی هلیکوباکتر پیلوری قرار گرفتند، نسبت به افرادی که دارونما دریافت کردند، نصف بود (50). نکته مهم این است که یک مطالعه کوهورت مبتنی بر جمعیت در سراسر کشور در سوئد هیچ مدرکی مبنی بر افزایش آدنوکارسینوم مری پس از درمان ریشهکنی هلیکوباکتر پیلوری پیدا نکرد (51).
چه کسی باید برای عفونت هلیکوباکتر پیلوری آزمایش و درمان شود ؟
طبق گفته مراکز کنترل و پیشگیری از بیماریها، افرادی که زخم معده یا اثنی عشر فعال دارند یا سابقه مستندی از زخم دارند، باید از نظر وجود هلیکوباکتر پیلوری آزمایش شوند و در صورت وجود عفونت، تحت درمان قرار گیرند. آزمایش و درمان عفونت هلیکوباکتر پیلوری همچنین پس از جراحی سرطان معده در مراحل اولیه یا لنفوم MALT معده با درجه پایین توصیه میشود (52-54) . با این حال، اکثر متخصصان موافقند که شواهد موجود از آزمایش گسترده و ریشهکنی عفونت هلیکوباکتر پیلوری پشتیبانی نمیکند ( 52، 55). درمان ریشهکنی غیرضروری یا نامناسب ممکن است در افزایش مقاومت هلیکوباکتر پیلوری در برابر چندین آنتیبیوتیک در ایالات متحده نقش داشته باشد (56).
منابع منتخب
- Atherton JC. The pathogenesis of Helicobacter pylori-induced gastro-duodenal diseases. Annual Review of Pathology 2006; 1:63–96. [PubMed Abstract]
- Kusters JG, van Vliet AH, Kuipers EJ. Pathogenesis of Helicobacter pylori infection. Clinical Microbiology Reviews 2006; 19(3):449–490. [PubMed Abstract]
- Grad YH, Lipsitch M, Aiello AE. Secular trends in Helicobacter pylori seroprevalence in adults in the United States: Evidence for sustained race/ethnic disparities. American Journal of Epidemiology 2012; 175(1):54–59. [PubMed Abstract]
- Duan M, Li Y, Liu J, et al. Transmission routes and patterns of helicobacter pylori. Helicobacter 2023; 28(1):e12945. [PubMed Abstract]
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Schistosomes, Liver Flukes and Helicobacter pylori. Lyon (FR): International Agency for Research on Cancer; 1994. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, No. 61. P. 1–241.
- Zhou BG, Mei YZ, Wang JS, et al. Is Helicobacter pylori infection associated with pancreatic cancer? A systematic review and meta-analysis of observational studies. Therapeutic Advances in Chronic Disease 2023; 14:20406223231155119. [PubMed Abstract]
- Butt J, Epplein M. Helicobacter pylori and colorectal cancer—A bacterium going abroad? PLoS Pathogens 2019; 15(8):e1007861. doi: 10.1371/journal.ppat.1007861.
- Zuo Y, Jing Z, Bie M, et al. Association between Helicobacter pylori infection and the risk of colorectal cancer: A systematic review and meta-analysis. Medicine (Baltimore) 2020; 99(37):e21832. [PubMed Abstract]
- Boustany A, Onwuzo S, Almomani A, Asaad I. Epidemiology and risk of colorectal cancer in patients with a history of Helicobacter pylori infection: A population-based study. Annals of Gastroenterology 2023; 36(2):203–207. [PubMed Abstract]
- Helicobacter and Cancer Collaborative Group. Gastric cancer and Helicobacter pylori: A combined analysis of 12 case–control studies nested within prospective cohorts. Gut 2001; 49(3):347–353. [PubMed Abstract]
- Parsonnet J, Friedman GD, Vandersteen DP, et al. Helicobacter pylori infection and the risk of gastric carcinoma. New England Journal of Medicine 1991; 325(16):1127–1131. [PubMed Abstract]
- Huang JQ, Sridhar S, Chen Y, Hunt RH. Meta-analysis of the relationship between Helicobacter pylori seropositivity and gastric cancer. Gastroenterology 1998; 114(6):1169–1179. [PubMed Abstract]
- Eslick GD, Lim LL, Byles JE, Xia HH, Talley NJ. Association of Helicobacter pylori infection with gastric carcinoma: A meta-analysis. American Journal of Gastroenterology 1999; 94(9):2373–2379. [PubMed Abstract]
- Uemura N, Okamoto S, Yamamoto S, et al. Helicobacter pylori infection and the development of gastric cancer. New England Journal of Medicine 2001; 345(11):784–789. [PubMed Abstract]
- Kamangar F, Dawsey SM, Blaser MJ, et al. Opposing risks of gastric cardia and noncardia gastric adenocarcinomas associated with Helicobacter pylori seropositivity. Journal of the National Cancer Institute 2006; 98(20):1445–1452. [PubMed Abstract]
- Yao P, Kartsonaki C, Butt J, et al. Helicobacter pylori multiplex serology and risk of non-cardia and cardia gastric cancer: A case–cohort study and meta-analysis. International Journal of Epidemiology 2023:dyad007. [PubMed Abstract]
- Morais S, Costa A, Albuquerque G, et al. “True” Helicobacter pylori infection and non-cardia gastric cancer: A pooled analysis within the Stomach Cancer Pooling (StoP) Project. Helicobacter 2022; 27(3):e12883. [PubMed Abstract]
- Yang L, Kartsonaki C, Yao P, et al. The relative and attributable risks of cardia and non-cardia gastric cancer associated with Helicobacter pylori infection in China: A case–cohort study. The Lancet. Public Health 2021; 6(12):e888–e896. [PubMed Abstract]
- Han Z, Liu J, Zhang W, et al. Cardia and non-cardia gastric cancer risk associated with Helicobacter pylori in East Asia and the West: A systematic review, meta-analysis, and estimation of population attributable fraction. Helicobacter 2023 Jan 16:e12950. [PubMed Abstract]
- Li WQ, Zhang JY, Ma JL, et al. Effects of Helicobacter pylori treatment and vitamin and garlic supplementation on gastric cancer incidence and mortality: Follow-up of a randomized intervention trial. BMJ 2019; 366:l5016. [PubMed Abstract]
- Choi IJ, Kim CG, Lee JY, et al. Family history of gastric cancer and Helicobacter pylori treatment. New England Journal of Medicine 2020; 382(5):427–436. [PubMed Abstract]
- Lee YC, Chiang TH, Chou CK, et al. Association between Helicobacter pylori eradication and gastric cancer incidence: A systematic review and meta-analysis. Gastroenterology 2016; 150(5):1113–1124.e5. [PubMed Abstract]
- Parsonnet, J, Hansen S, Rodriguez L, et al. Helicobacter pylori infection and gastric lymphoma. New England Journal of Medicine 1994; 330(18):1267–1271. [PubMed Abstract]
- de Sanjose S, Dickie A, Alvaro T, et al. Helicobacter pylori and malignant lymphoma in Spain. Cancer Epidemiology, Biomarkers & Prevention 2004; 13(6):944–948. [PubMed Abstract]
- Fischbach W, Goebeler-Kolve ME, Dragosics B, Greiner A, Stolte M. Long term outcome of patients with gastric marginal zone B cell lymphoma of mucosa associated lymphoid tissue (MALT) following exclusive Helicobacter pylori eradication therapy: Experience from a large prospective series. Gut 2004; 53(1):34–37. [PubMed Abstract]
- Stathis A, Chini C, Bertoni F, et al. Long-term outcome following Helicobacter pylori eradication in a retrospective study of 105 patients with localized gastric marginal zone B-cell lymphoma of MALT type. Annals of Oncology 2009; 20(6):1086–1093. [PubMed Abstract]
- Siegel RL, Miller KD, Wagle NS, Jemal A. Cancer statistics, 2023. CA: A Cancer Journal for Clinicians 2023; 73(1):17–48. [PubMed Abstract]
- Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians 2021; 71(3):209–249. [PubMed Abstract]
- World Cancer Research Fund International. Stomach cancer statistics. Accessed February 28, 2023. (https://www.wcrf.org/cancer-trends/stomach-cancer-statistics/)
- Rawla P, Barsouk A. Epidemiology of gastric cancer: Global trends, risk factors and prevention. Przegla̜d gastroenterologiczny (Gastroenterology review) 2019; 14(1):26–38. [PubMed Abstract]
- Morgan E, Arnold M, Camargo MC, et al. The current and future incidence and mortality of gastric cancer in 185 countries, 2020–40: A population-based modelling study. EClinicalMedicine 2022; 47:101404. [PubMed Abstract]
- Anderson WF, Rabkin CS, Turner N, et al. The changing face of noncardia gastric cancer incidence among US non-Hispanic Whites. Journal of the National Cancer Institute 2018; 110(6):608–615. [PubMed Abstract]
- de Martel C, Forman D, Plummer M. Gastric cancer: Epidemiology and risk factors. Gastroenterology Clinics of North America 2013; 42(2):219–240. [PubMed Abstract]
- Wu XC, Andrews P, Chen VW, Groves FD. Incidence of extranodal non-Hodgkin lymphomas among whites, blacks, and Asians/Pacific Islanders in the United States: Anatomic site and histology differences. Cancer Epidemiology 2009; 33(5):337–346. [PubMed Abstract]
- de Martel C, Georges D, Bray F, Ferlay J, Clifford GM. Global burden of cancer attributable to infections in 2018: A worldwide incidence analysis. The Lancet. Global Health 2020; 8(2):e180–e190. [PubMed Abstract]
- Islami F, Kamangar F. Helicobacter pylori and esophageal cancer risk: A meta-analysis. Cancer Prevention Research 2008; 1(5):329–338. [PubMed Abstract]
- Xie FJ, Zhang YP, Zheng QQ, et al. Helicobacter pylori infection and esophageal cancer risk: An updated meta-analysis. World Journal of Gastroenterology 2013; 19(36):6098–6107. [PubMed Abstract]
- Nie S, Chen T, Yang X, Huai P, Lu M. Association of Helicobacter pylori infection with esophageal adenocarcinoma and squamous cell carcinoma: A meta-analysis. Diseases of the Esophagus 2014; 27(7):645–653. [PubMed Abstract]
- Ye W, Held M, Lagergren J, et al. Helicobacter pylori infection and gastric atrophy: Risk of adenocarcinoma and squamous-cell carcinoma of the esophagus and adenocarcinoma of the gastric cardia. Journal of the National Cancer Institute 2004; 96(5):388–396. [PubMed Abstract]
- Whiteman DC, Parmar P, Fahey P, et al. Association of Helicobacter pylori infection with reduced risk for esophageal cancer is independent of environmental and genetic modifiers. Gastroenterology 2010; 139(1):73–83; quiz e11-2. [PubMed Abstract]
- Miftahussurur M, Yamaoka Y, Graham DY. Helicobacter pylori as an oncogenic pathogen, revisited. Expert Reviews in Molecular Medicine 2017; 19:e4. [PubMed Abstract]
- Tu S, Bhagat G, Cui G, et al. Overexpression of interleukin-1beta induces gastric inflammation and cancer and mobilizes myeloid-derived suppressor cells in mice. Cancer Cell 2008; 14(5):408–419. [PubMed Abstract]
- Murata-Kamiya N. Pathophysiological functions of the CagA oncoprotein during infection by Helicobacter pylori. Microbes and Infection 2011; 13(10):799–807. [PubMed Abstract]
- Huang JQ, Zheng GF, Sumanac K, Irvine EJ, Hunt RH. Meta-analysis of the relationship between cagA seropositivity and gastric cancer. Gastroenterology 2003; 125(6):1636–1644. [PubMed Abstract]
- Butt J, Varga MG, Wang T, et al. Smoking, Helicobacter pylori serology, and gastric cancer risk in prospective studies from China, Japan, and Korea. Cancer Prevention Research 2019; 12(10):667–674. [PubMed Abstract]
- Gaddy JA, Radin JN, Loh JT, et al. High dietary salt intake exacerbates Helicobacter pylori-induced gastric carcinogenesis. Infection and Immunity 2013;81(6):2258–2267. [PubMed Abstract]
- Wang XQ, Terry PD, Yan H. Review of salt consumption and stomach cancer risk: Epidemiological and biological evidence. World Journal of Gastroenterology 2009; 15(18):2204–2213. [PubMed Abstract]
- Ford AC, Yuan Y, Forman D, Hunt R, Moayyedi P. Helicobacter pylori eradication for the prevention of gastric neoplasia. Cochrane Database of Systematic Reviews 2020; 7(7):CD005583. [PubMed Abstract]
- Chiang TH, Chang WJ, Chen SL, et al. Mass eradication of Helicobacter pylori to reduce gastric cancer incidence and mortality: A long-term cohort study on Matsu Islands. Gut 2021; 70(2):243–250. [PubMed Abstract]
- Choi IJ, Kook MC, Kim YI, et al. Helicobacter pylori therapy for the prevention of metachronous gastric cancer. New England Journal of Medicine 2018; 378(12):1085–1095. [PubMed Abstract]
- Doorakkers E, Lagergren J, Santoni G, Engstrand L, Brusselaers N. Helicobacter pylori eradication treatment and the risk of Barrett’s esophagus and esophageal adenocarcinoma. Helicobacter 2020; 25(3):e12688. [PubMed Abstract]
- Chey WD, Leontiadis GI, Howden CW, Moss SF. ACG clinical guideline: Treatment of Helicobacter pylori infection. American Journal of Gastroenterology 2017; 112(2):212–239. [PubMed Abstract]
- Katelaris P, Hunt R, Bazzoli F, et al. Helicobacter pylori World Gastroenterology Organization global guideline. Journal of Clinical Gastroenterology 2023; 57(2):111–126. [PubMed Abstract]
- Malfertheiner P, Megraud F, Rokkas T, et al. Management of Helicobacter pylori infection: The Maastricht VI/Florence consensus report. Gut 2022: gutjnl-2022-327745. [PubMed Abstract]
- Herrero R, Park JY, Forman D. The fight against gastric cancer – the IARC Working Group report. Best Practice and Research. Clinical Gastroenterology 2014; 28(6):1107–1114. [PubMed Abstract]
- Ho JJC, Navarro M, Sawyer K, Elfanagely Y, Moss SF. Helicobacter pylori antibiotic resistance in the United States between 2011 and 2021: A systematic review and meta-analysis. American Journal of Gastroenterology 2022; 117(8):1221–1230. [PubMed Abstract]
تهیه و تنظیم: سید طه نوربخش
تأیید و نظارت: فائزه محمدهاشم-متخصص ژنتیک