آنچه در این مطلب خواهید خواند
مقدمه
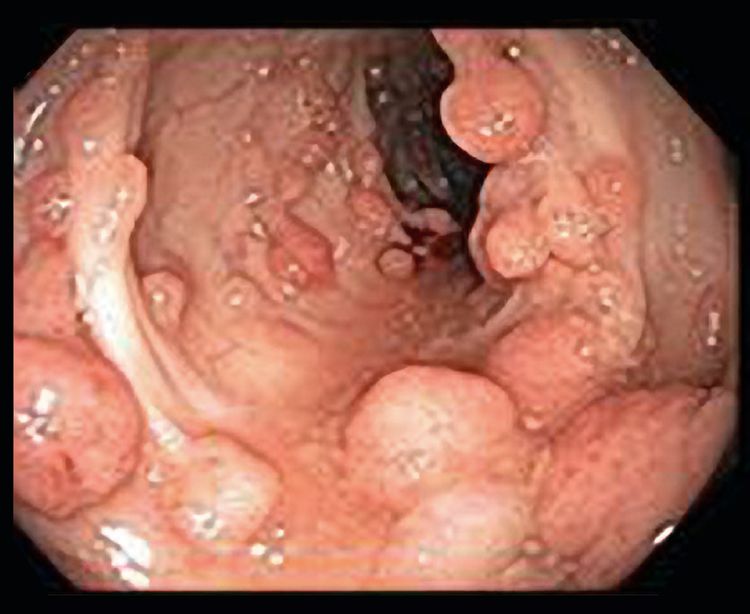
تا سال 1900، چندین گزارش نشان داده بودند که بیمارانی که تعداد زیادی پولیپ (که بعداً به عنوان آدنوم طبقهبندی شدند) داشتند، در معرض خطر بسیار بالای ابتلا به سرطان روده بزرگ (CRC) بودند و الگوی انتقال در خانوادهها اتوزومال غالب بود. در قرن بیستم، پیشرفت آدنوم به کارسینوم تأیید شد و FAP به عنوان مدل اولیه برای این پیشرفت شناخته شد.FAP کلاسیک با پولیپهای آدنوماتوز متعدد (صدها تا هزاران) در روده بزرگ و راست روده که پس از دهه اول زندگی ایجاد میشوند، مشخص میشود.
همچنین زیرمجموعهای از FAP کلاسیک وجود دارد که فنوتیپ ضعیفتری دارد. AFAP یک بیماری بالینی ناهمگن است که با پولیپهای آدنوماتوز کمتر در روده بزرگ و راست روده نسبت به FAP کلاسیک مشخص میشود (پولیپوز آدنوماتوز خانوادگی ضعیفشده [AFAP]).
FAP یکی از واضحترین و شناختهشدهترین سندرمهای سرطان روده بزرگ ارثی است [1-13]. این یک بیماری اتوزومال غالب است و میزان بروز گزارششده آن از 1 در 7000 تا 1 در 22000 تولد زنده متغیر است [14]. وجود تفاوتهای قومی در شیوع FAP مطرح شده است [14] اما یک مطالعه بزرگ، تفاوتهای معنیداری را در تنوع قومی در بیش از 6169 فرد با سابقه شخصی و/یا خانوادگی سرطان روده بزرگ و پولیپ که برای آزمایش ژنتیک به یک آزمایشگاه مرجع بزرگ ارجاع داده شده بودند، پیدا نکرد [15]. اکثر موارد FAP ناشی از واریانتهای بیماریزا در ژن APC روی کروموزوم 5q21 است.
علاوه بر خطر بالای آدنومهای روده بزرگ در بیماران FAP، تظاهرات خارج رودهای مختلفی نیز شرح داده شده است، از جمله آدنومها و آدنوکارسینومهای دستگاه گوارش فوقانی (GI)؛ پولیپهای معده غده فوندیک؛ تومورهای خوشخیم غیر اپیتلیال (استئوماها، کیستهای اپیدرمی، ناهنجاریهای دندانی)؛ تومورهای دسموئید؛ هیپرتروفی مادرزادی اپیتلیوم رنگدانه شبکیه (CHRPE)؛ و تومورهای بدخیم (تومورهای تیروئید و مغز، هپاتوبلاستوما). برای خطرات این تظاهرات خارج رودهای در FAP به جدول 1 مراجعه کنید.
جدول 1. خطرات تومور خارج رودهای در پولیپوز آدنوماتوز خانوادگی
| بدخیمی | ریسک نسبی | ریسک مطلق مادام العمر (%) |
|---|---|---|
| تومور دسموئید | ۸۵۲.۰ | ۱۵.۰ |
| تومورها و سرطان اثنی عشر | ۳۳۰.۸ | ۵.۰–۱۲.۰ |
| سرطان تیروئید | ۷.۶ | ۲.۰ |
| سرطان مغز | ۷.۰ | ۲.۰ |
| سرطان آمپولار | ۱۲۳.۷ | ۱.۷ |
| سرطان پانکراس | ۴.۵ | ۱.۷ |
| هپاتوبلاستوما | ۸۴۷.۰ | ۱.۶ |
| سرطان معده | تعریف نشده | ۰.۶ آ |
| برگرفته از Giardiello و همکاران، [16] Jagelman و همکاران، [17] Sturt و همکاران، [18] Lynch و همکاران، [19] Bülow و همکاران، [20] Burt و همکاران، [21] و Galiatsatos [22] . | ||
FAP همچنین به عنوان پولیپوزیس کولی خانوادگی یا پولیپوزیس کولی آدنوماتوز (APC) شناخته شده است. سندرم گاردنر قبلاً برای بیماران FAP که با پولیپوزیس کولورکتال، استئوما و تومورهای بافت نرم تظاهر میکردند، تشخیص داده میشد. با این حال، از نظر ژنتیکی نشان داده شده است که سندرم گاردنر نوعی از FAP است و بنابراین اصطلاح سندرم گاردنر اساساً در عمل بالینی منسوخ شده است [ 23 ].
فنوتیپ بالینی
آدنومهای روده بزرگ و سرطان کولورکتال (CRC)
افرادی که یک واریانت بیماریزا در ژن APC را به ارث میبرند، احتمال بسیار بالایی برای ابتلا به آدنومهای روده بزرگ دارند؛ این خطر بیش از 90٪ تخمین زده شده است.[ 1، 12، 13] سن شروع آدنومها در روده بزرگ متغیر است و میانگین سنی برای ظهور آدنومهای روده بزرگ 16 سال است [24] تا سن 10 سالگی، تنها 15٪ از حاملان واریانت ژرملاین APC آدنومها را نشان میدهند؛ تا سن 20 سالگی، این احتمال به 75٪ افزایش مییابد؛ و تا سن 30 سالگی، 90٪ با FAP مواجه خواهند شد.[ 1، 12، 13، 24، 25] استثنا AFAP است که در آن افراد مبتلا معمولاً پولیپهای روده بزرگ کمتری دارند که عمدتاً در روده بزرگ راست هستند و شروع سرطان روده بزرگ در آنها دیرتر است. بدون هیچ مداخلهای، اکثر افراد مبتلا به FAP تا دهه چهارم زندگی به CRC مبتلا میشوند [ 1، 12، 13]. بنابراین، نظارت و مداخله برای ناقلین یک گونه بیماریزای APC و افراد در معرض خطر، به طور مرسوم شامل کولونوسکوپی سالانه از حوالی بلوغ برای تشخیص زودهنگام پولیپهای روده بزرگ و کمک به برنامهریزی زمان انجام کولکتومی بوده است [26، 27].
تظاهرات خارج رودهای
هیپرتروفی مادرزادی اپیتلیوم رنگدانه شبکیه (CHRPE)
CHRPE ضایعات مسطح و تیره رنگی در شبکیه هستند که تقریباً در 75٪ از بیماران مبتلا به FAP وجود دارند [28، 29] در مقایسه با فراوانی 1.2٪ در جمعیت عمومی [ 30 ]. این ضایعات اغلب در بدو تولد یا در اوایل کودکی وجود دارند و اغلب در بیماران FAP متعدد یا دو طرفه هستند.[ 31 ] مطالعهای بر روی 17 فرد مبتلا به FAP و 13 عضو خانواده در معرض خطر، حساسیت وجود ضایعه CHRPE در ارتباط با پولیپهای روده بزرگ در FAP را 76٪، ویژگی 92٪، ارزش پیشبینی مثبت 93٪ و ارزش پیشبینی منفی 75٪ گزارش کرد. بنابراین، غربالگری افراد در معرض خطر برای CHRPE میتواند یک روش معقول برای تشخیص FAP باشد [ 28 ].
تومورهای دسموئید
تومورهای دسموئید، تومورهای فیبروماتوز تکثیرشونده، مهاجم موضعی، غیرمتاستازدهنده در یک ماتریکس کلاژن هستند. اگرچه متاستاز نمیدهند، اما میتوانند بسیار تهاجمی رشد کنند و تهدیدکننده زندگی باشند [ 32 ]. دسموئیدها ممکن است به صورت پراکنده، به عنوان بخشی از FAP کلاسیک، یا به صورت ارثی بدون یافتههای FAP در روده بزرگ رخ دهند [19، 33]. دسموئیدها حتی زمانی که با پولیپوز آدنوماتوز معمولی روده بزرگ مرتبط نیستند، با انواع بیماریزای ارثی APC مرتبط بودهاند [ 33 ، 34 ].
بیشتر مطالعات نشان دادهاند که 10٪ از بیماران FAP دچار دسموئید میشوند، که دامنه گزارش شده آن از 8٪ تا 38٪ است. میزان بروز آن بسته به روش تشخیص و محل واریانت بیماریزا در ژن APC متفاوت است [ 33، 35، 36] واریانتهای بیماریزای APC که بین کدونهای 1445 و 1578 رخ میدهند، با افزایش بروز تومورهای دسموئید در بیماران FAP مرتبط بودهاند.[ 34، 37-39 ] تومورهای دسموئید با شروع دیررس و فنوتیپ پولیپوز رودهای خفیفتر (بیماری دسموئید ارثی ) در بیمارانی با واریانتهای بیماریزا در کدون 1924 توصیف شدهاند [33].
مقیاس عامل خطر دسموئید در تلاشی برای شناسایی بیمارانی که احتمال ابتلا به تومورهای دسموئید در آنها وجود دارد، توصیف شده است [ 40 ]. مقیاس عامل خطر دسموئید بر اساس جنسیت، وجود یا عدم وجود تظاهرات خارج رودهای، سابقه خانوادگی دسموئید و ژنوتیپ، در صورت وجود، بود. با استفاده از این مقیاس، طبقهبندی بیماران FAP به گروههای کمخطر، متوسط و پرخطر برای ابتلا به تومورهای دسموئید امکانپذیر شد. نویسندگان نتیجه گرفتند که مقیاس عامل خطر دسموئید میتواند برای برنامهریزی جراحی استفاده شود. اعتبارسنجی عوامل خطر تشکیلدهنده این مقیاس توسط یک مطالعه گذشتهنگر بزرگ، چند ثبتی از اروپا پشتیبانی شد [ 41 ].
سیر طبیعی دسموئیدها متغیر است. برخی از نویسندگان مدلی را برای تشکیل تومور دسموئید پیشنهاد کردهاند که در آن عملکرد غیرطبیعی فیبروبلاست منجر به ضایعات پیشساز دسموئید مزانتریک و پلاکمانند میشود که در برخی موارد قبل از جراحی رخ میدهند و پس از ترومای جراحی به فیبروماتوز مزانتریک پیشرفت میکنند و در نهایت منجر به تومورهای دسموئید میشوند [ 42 ]. تخمین زده میشود که 10٪ از دسموئیدها برطرف میشوند، 50٪ برای مدت طولانی پایدار میمانند، 30٪ نوسان میکنند و 10٪ به سرعت رشد میکنند [43]. دسموئیدها اغلب پس از ترومای جراحی یا فیزیولوژیکی رخ میدهند و عوامل غدد درونریز و ژنتیکی در آن دخیل بودهاند. تقریباً 80٪ از دسموئیدهای داخل شکمی در FAP پس از ترومای جراحی رخ میدهند [44 ، 45].
دسموئیدها در FAP اغلب داخل شکمی هستند، ممکن است در مراحل اولیه بروز کنند و میتوانند منجر به انسداد روده یا انفارکتوس و/یا انسداد حالبها شوند [36]. در برخی از سریها، دسموئیدها دومین علت شایع مرگ پس از سرطان کولورکتال (CRC) در بیماران FAP هستند [46، 47] یک سیستم مرحلهبندی برای تسهیل طبقهبندی دسموئیدهای داخل شکمی بر اساس شدت بیماری پیشنهاد شده است [ 48 ]. سیستم مرحلهبندی پیشنهادی برای دسموئیدهای داخل شکمی به شرح زیر است: مرحله I برای دسموئیدهای بدون علامت و بدون رشد؛ مرحله II برای دسموئیدهای علامتدار و بدون رشد با حداکثر قطر 10 سانتیمتر یا کمتر؛ مرحله III برای دسموئیدهای علامتدار 11 سانتیمتر تا 20 سانتیمتر یا برای دسموئیدهای بدون علامت و با رشد آهسته؛ و مرحله IV برای دسموئیدهای بزرگتر از 20 سانتیمتر، یا با رشد سریع، یا با عوارض تهدیدکننده زندگی [48].
این دادهها نشان میدهند که آزمایش ژنتیک میتواند در مدیریت پزشکی بیماران مبتلا به FAP و/یا تومورهای دسموئید متعدد ارزشمند باشد. افرادی که ژنوتیپهای APC مستعد تشکیل دسموئید دارند (مثلاً در انتهای 3′ یا کدون 1445 ژن APC ) به نظر میرسد در معرض خطر بالای ابتلا به دسموئید پس از هرگونه جراحی، از جمله کولکتومی کاهشدهنده خطر و اقدامات نظارتی جراحی مانند لاپاراسکوپی، هستند [35، 43، 49].
تومورهای معده
شایعترین پولیپهای معده مرتبط با FAP، پولیپهای غده فوندوس (FGP) هستند. FGPها اغلب منتشر هستند و با آندوسکوپی قابل برداشتن نیستند. میزان بروز FGPها در بیماران مبتلا به FAP تا 60٪ تخمین زده شده است، در حالی که این میزان در جمعیت عمومی 0.8٪ تا 1.9٪ است [ 20، 22، 50-54] این پولیپها از غدد فوندوس تحریف شده حاوی میکروکیستهایی تشکیل شدهاند که با سلولهای اپیتلیال نوع فوندوس یا سلولهای مخاطی فوئولار پوشیده شدهاند [55، 56]
اپیتلیوم سطحی هیپرپلاستیک، طبق تعریف، غیر نئوپلاستیک است. بر این اساس، FGPها پیش سرطانی در نظر گرفته نشدهاند. با این حال، گزارشهای موردی از سرطان معده که ظاهراً از FGPها ناشی میشوند، منجر به بررسی مجدد این موضوع شده است.[22، 57] در یک سری FAP، دیسپلازی کانونی در اپیتلیوم سطحی FGPها در 25٪ از بیماران در مقابل 1٪ از FGPهای پراکنده مشهود بود [56] در یک مطالعه آیندهنگر از بیماران مبتلا به FAP که تحت نظارت با ازوفاگوگاسترودئودنوسکوپی قرار گرفتند، FGPها در 88٪ از بیماران تشخیص داده شدند. دیسپلازی درجه پایین در 38٪ از این بیماران تشخیص داده شد، در حالی که دیسپلازی درجه بالا در 3٪ از این بیماران تشخیص داده شد. نویسندگان این مطالعه توصیه کردند که در صورت شناسایی پولیپ با دیسپلازی درجه بالا، پولیپکتومی با نظارت آندوسکوپی مکرر در 3 تا 6 ماه در نظر گرفته شود.[ 58 ]
با پیچیدهتر شدن مسئله تشخیص افتراقی، FGPها به طور فزایندهای در بیماران غیر FAP که مهارکنندههای پمپ پروتون (PPI) مصرف میکنند، شناسایی شدهاند.[ 56 ، 59 ] FGPها در این شرایط معمولاً اثر PPI را نشان میدهند که شامل احتقان گرانولهای ترشحی در سلولهای جداری است و منجر به برآمدگی نامنظم سلولهای منفرد به داخل لومن غدد میشود. از نظر چشم آموزشدیده، وجود دیسپلازی و عدم وجود همزمان اثر مشخص PPI میتواند به شدت نشاندهنده وجود FAP زمینهای باشد. تعداد FGPها در FAP بیشتر از تعداد مشاهده شده در بیماران مصرفکننده PPI است، اگرچه تا حدودی همپوشانی وجود دارد.
آدنومهای معده نیز در بیماران مبتلا به FAP رخ میدهند. میزان بروز آدنومهای معده در بیماران غربی بین 2 تا 12 درصد گزارش شده است، در حالی که در ژاپن، میزان بروز بین 39 تا 50 درصد گزارش شده است.[ 60-63 ] این آدنومها میتوانند به سرطان معده تبدیل شوند. بیماران مبتلا به FAP در کره و ژاپن در مقایسه با افراد جمعیت عمومی در این کشورها، سه تا چهار برابر بیشتر در معرض خطر ابتلا به سرطان معده هستند. این یافته در جمعیتهای غربی مشاهده نشد [64-68]. افزایش شیوع آدنومهای معده در بیماران آسیایی مبتلا به FAP ممکن است به دلیل شیوع بالای عفونتهای هلیکوباکتر پیلوری در این جمعیت باشد [61].
اخیراً، افزایش بروز آدنوکارسینوم معده در یک پایگاه داده FAP غربی مشاهده شده است.[ 69 ] تغییرات در پروموتر (1B) ژن APC در خانوادههایی با آدنوکارسینوم معده و پولیپوز پروگزیمال معده (GAPPS) کشف شد که پولیپهای معده متعدد، عمدتاً غده فوندیک، محدود به بدنه و فوندوس با نواحی دیسپلازی یا آدنوکارسینوم معده را نشان میدهند و هیچ مدرکی از پولیپوز کولورکتال یا دوازدهه ندارند. این گونهها با فنوتیپ معده در خانوادههای متعدد GAPPS جدا میشوند. اگرچه نفوذ فنوتیپ پولیپوز معده زیاد است، اما فنوتیپ میتواند از بزرگسالان بدون علامت تا نوجوانانی که با پولیپوز معده علامتدار گسترده مراجعه میکنند، و همچنین ناقلین بدون بیماری که در سنین 42 تا 77 سال آندوسکوپی تمیز داشتهاند، متفاوت باشد. با این حال، نفوذ سرطان معده کمتر مشخص است. تغییرات پروموتر 1B APC به ندرت در خانوادههای FAP با پولیپ غده فوندوس معده و پولیپوز کولون رخ میدهد [ 70 ].
تومورهای دوازدهه/روده کوچک
در حالی که میزان بروز آدنومهای دوازدهه در بیماران غیر منتخبی که تحت آندوسکوپی دستگاه گوارش فوقانی قرار میگیرند، تنها 0.4٪ است،[ 71 ] آدنومهای دوازدهه در 80٪ تا 100٪ از بیماران FAP یافت میشوند. اکثر آنها در قسمتهای اول و دوم دوازدهه، به ویژه در ناحیه پریآمپولاری قرار دارند.[ 50 ، 51 ، 72 ] در یک مطالعه آیندهنگر چند مرکزی بر روی آدنومهای دوازدهه در 368 شرکتکننده از شمال اروپا با FAP، 65٪ در ارزیابی اولیه (میانگین سنی 38 سال) آدنوم داشتند و شیوع تجمعی تا سن 70 سالگی به 90٪ رسید. برخلاف باورهای قبلی در مورد سیر بالینی کند، آدنومها در طول 8 سال نظارت متوسط، از نظر اندازه و درجه دیسپلازی افزایش یافتند، اگرچه تنها 4.5٪ در طول نظارت آیندهنگر به سرطان مبتلا شدند [ 20 ]. این یک مطالعه بزرگ است؛ با این حال، این روش به دلیل استفاده از آندوسکوپی رو به جلو به جای آندوسکوپی پهلو و تعداد زیاد محققان درگیر در این مطالعه، محدود شده است. پولیپهای روده را میتوان در بیماران FAP با استفاده از آندوسکوپی کپسولی نیز ارزیابی کرد.[ 73-75] یک مطالعه در مورد دئودنوگرافی توموگرافی کامپیوتری (CT) نشان داد که اندازه آدنوم بزرگتر را میتوان به طور دقیق اندازهگیری کرد، اما آدنومهای کوچکتر و مسطحتر را نمیتوان به طور دقیق شمارش کرد [76].
تقریباً 1.7٪ از کل موارد سرطان اثنی عشر به FAP نسبت داده میشود [17 ، 66، 77-79] میزان بروز آدنوکارسینوم اثنی عشر در FAP در طول عمر 4 تا 12 درصد است. یک بررسی گذشتهنگر از بیماران FAP نشان داد که توالی آدنوم-کارسینوم برای آدنوکارسینومهای پریآمپولاری با تشخیص آدنوم در میانگین سنی 39 سال، دیسپلازی درجه بالا در میانگین سنی 47 سال و آدنوکارسینوم در میانگین سنی 54 سال، به صورت زمانی رخ داده است.[ 80 ] تجزیه و تحلیل تصمیمگیری 601 بیمار FAP نشان داد که مزیت نظارت دورهای از سن 30 سالگی منجر به افزایش امید به زندگی 7 ماه شده است [ 77 ] اگرچه درمان پولیپها در دوازدهه میتواند دشوار باشد، اما سریهای کوچک نشان میدهند که میتوان آنها را با آندوسکوپی با موفقیت مدیریت کرد، اما با عوارض بالقوه – عمدتاً از پانکراتیت، خونریزی و سوراخ شدن دوازدهه [81، 82].
بیماران مبتلا به FAP با پولیپوز اثنی عشر شدید، که گاهی اوقات پولیپوز متراکم نامیده میشود، یا با آدنومهای اثنی عشر پیشرفته از نظر بافتشناسی، به نظر میرسد در معرض بیشترین خطر ابتلا به آدنوکارسینوم اثنی عشر هستند.[20، 78، 83، 84] از آنجا که خطر آدنوکارسینوم اثنی عشر با تعداد و اندازه پولیپها و شدت دیسپلازی پولیپها مرتبط است، یک سیستم طبقهبندی که این ویژگیها را در بر میگیرد، برای تلاش برای شناسایی افرادی که FAP دارند و در معرض بیشترین خطر ابتلا به آدنوکارسینوم اثنی عشر هستند، توسعه داده شد [84]. طبق این سیستم، که به عنوان طبقهبندی اشپیگلمن شناخته میشود (به جدول 2 مراجعه کنید)، 36٪ از بیماران با پیشرفتهترین مرحله، به سرطان مبتلا میشوند [ 78 ].
سودمندی پیشبینیکنندهی طبقهبندی اشپیگلمن زیر سوال رفته است. سیستم امتیازدهی برای دیسپلازی، دیسپلازی را به صورت خفیف، متوسط یا شدید طبقهبندی میکند، اما پاتولوژیستها معمولاً سعی در تشخیص دیسپلازی متوسط از درجه پایین ندارند. هیچ مطالعهای وجود ندارد که توافق بین ناظران را در طبقهبندی جزء پرزدار یا تفسیر درجه دیسپلازی تأیید کند. مطالعهای از کلینیک کلیولند که طبقهبندی اشپیگلمن و اجزای آن را در بیماران مبتلا به FAP با و بدون سرطان مقایسه میکند، نشان داد که نه تعداد آدنوم و نه جزء پرزدار، هیچکدام پیشبینیکنندهی خطر سرطان نیستند [ 85 ]. در حالی که بیماران با طبقهبندی پیشرفته (اشپیگلمن IV) بیشتر احتمال ابتلا به سرطان داشتند، تقریباً نیمی از مبتلایان به سرطان معیارهای اشپیگلمن IV را نداشتند.
جدول 2. طبقه بندی اسپیگلمن
| امتیازها | شماره پولیپ | اندازه پولیپ (میلیمتر) | بافتشناسی | دیسپلازی |
|---|---|---|---|---|
| ۱ | ۱–۴ | ۱–۴ | لولهای | خفیف |
| ۲ | ۵–۲۰ | ۵–۱۰ | توبولوویلوس | متوسط |
| ۳ | >20 | >10 | کرکی | شدید |
| مرحله اول، 1-4 امتیاز؛ مرحله دوم، 5-6 امتیاز؛ مرحله سوم، 7-8 امتیاز؛ مرحله چهارم، 9-12 امتیاز [84] | ||||
تومورهای دیگر
سایر تومورهای خارج رودهای که در بیماران FAP ایجاد میشوند شامل سرطان پاپیلاری تیروئید، تومورهای آدرنال، هپاتوبلاستوما و تومورهای مغزی هستند.
گزارش شده است که سرطان پاپیلاری تیروئید (نوع مورولار کریبریفرم) 1 تا 2 درصد از بیماران مبتلا به FAP را تحت تأثیر قرار میدهد.[ 86 ] با این حال، مطالعهای [ 87 ] روی سرطانهای پاپیلاری تیروئید در شش زن مبتلا به FAP نتوانست از دست دادن هتروزیگوسیتی (LOH) یا گونههای بیماریزای آلل نوع وحشی را در کدونهای 545 و 1061 تا 1678 از شش تومور نشان دهد. علاوه بر این، چهار نفر از پنج نفر از این بیماران ژنهای کایمریک سوماتیک RET/PTC قابل تشخیص داشتند . این گونه بیماریزا عموماً به کارسینومهای پاپیلاری تیروئید پراکنده محدود میشود، که نشاندهنده دخالت عوامل ژنتیکی غیر از گونههای بیماریزای APC است. مطالعات بیشتری برای نشان دادن اینکه آیا سایر عوامل ژنتیکی مانند ژن کایمریک RET/PTC به طور مستقل مسئول یا همکار گونههای APC در ایجاد سرطانهای پاپیلاری تیروئید در بیماران FAP هستند، مورد نیاز است.
تومورهای آدرنال در بیماران FAP گزارش شدهاند و یک مطالعه، LOH را در جایگاه APC در کارسینوم آدرنوکورتیکال (ACC) در یک بیمار FAP نشان داد [88]. در مطالعهای روی 162 بیمار FAP که برای ارزیابی تومورهای دسموئید داخل شکمی تحت سیتیاسکن شکم قرار گرفتند، 15 بیمار (11 زن) مبتلا به تومورهای آدرنال تشخیص داده شدند [89]. از این تعداد، دو نفر علائمی مربوط به ترشح بیش از حد کورتیزول داشتند. سه نفر از این بیماران تحت عمل جراحی بعدی قرار گرفتند و مشخص شد که ACC، هیپرپلازی ندولار دو طرفه یا آدنوم آدرنوکورتیکال دارند. شیوع نئوپلازی غیرمنتظره آدرنال در این گروه 7.4٪ بود که با شیوع 0.6٪ تا 3.4٪ ( P < .001) در بیماران غیر FAP مقایسه میشود [89]. هیچ تجزیه و تحلیل ژنتیکی مولکولی برای تومورهای برداشته شده در این سری ارائه نشد. یک مطالعه بعدی، ضایعات آدرنال را در 26٪ (23 از 90) بیماران مبتلا به FAP، 18٪ (2 از 11) بیماران مبتلا به AFAP و 24٪ (5 از 21) بیماران مبتلا به MAP شناسایی کرد. اکثر ضایعات در این مجموعه، سیر خوشخیم و با پیشرفت آهسته داشتند؛ هیچ موردی از ACC گزارش نشد [ 90 ].
هپاتوبلاستوما یک بدخیمی نادر، به سرعت پیشرونده و معمولاً کشنده در دوران کودکی است که اگر محدود به کبد باشد، میتوان آن را با جراحی رادیکال درمان کرد. موارد متعددی از هپاتوبلاستوما در کودکانی با گونه بیماریزای APC شرح داده شده است . [ 91-100 ] برخی از سریها همچنین LOH مربوط به APC را در این تومورها نشان دادهاند.[ 92، 94، 101] هیچ همبستگی ژنوتیپ-فنوتیپ خاصی در بیماران FAP مبتلا به هپاتوبلاستوما شناسایی نشده است.[ 102]
مجموعه تومورهای CRC و مغز به عنوان سندرم تورکات شناخته شده است؛ با این حال، سندرم تورکات از نظر مولکولی ناهمگن است. مطالعات مولکولی نشان دادهاند که پولیپوز روده بزرگ و مدولوبلاستوما با انواع بیماریزا در APC مرتبط هستند (بنابراین نشاندهنده FAP هستند)، در حالی که سرطان روده بزرگ و گلیوبلاستوما با انواع بیماریزا در ژنهای ترمیم عدم تطابق (MMR) مرتبط هستند (بنابراین نشاندهنده سندرم لینچ هستند) [103]
مدولوبلاستوما، یک تومور بسیار بدخیم سیستم عصبی مرکزی جنینی، تقریباً 80٪ از تومورهای مغزی یافت شده در FAP را تشکیل میدهد و عمدتاً در کودکانی رخ میدهد که 70٪ آنها قبل از 16 سالگی تشخیص داده میشوند. آستروسیتوماها و اپاندیموماهای درجه بالا نیز در بیماران FAP توصیف شدهاند. اگرچه خطر نسبی ابتلا به هر تومور مغزی در طول عمر در بین اعضای یک خانواده FAP 7 برابر و خطر مدولوبلاستوما 90 برابر افزایش مییابد، اما خطر مطلق ابتلا به هر تومور مغزی در طول عمر تقریباً 1٪ تا 2٪ است [103].
منابع
- Bussey HJ: Familial Polyposis Coli: Family Studies, Histopathology, Differential Diagnosis, and Results of Treatment. The Johns Hopkins University Press, 1975.
- Burt RW, Leppert MF, Slattery ML, et al.: Genetic testing and phenotype in a large kindred with attenuated familial adenomatous polyposis. Gastroenterology 127 (2): 444-51, 2004. [PUBMED Abstract]
- Choi YH, Cotterchio M, McKeown-Eyssen G, et al.: Penetrance of colorectal cancer among MLH1/MSH2 carriers participating in the colorectal cancer familial registry in Ontario. Hered Cancer Clin Pract 7 (1): 14, 2009. [PUBMED Abstract]
- Bonadona V, Bonaïti B, Olschwang S, et al.: Cancer risks associated with germline mutations in MLH1, MSH2, and MSH6 genes in Lynch syndrome. JAMA 305 (22): 2304-10, 2011. [PUBMED Abstract]
- Møller P, Seppälä T, Bernstein I, et al.: Cancer incidence and survival in Lynch syndrome patients receiving colonoscopic and gynaecological surveillance: first report from the prospective Lynch syndrome database. Gut 66 (3): 464-472, 2017. [PUBMED Abstract]
- Baglietto L, Lindor NM, Dowty JG, et al.: Risks of Lynch syndrome cancers for MSH6 mutation carriers. J Natl Cancer Inst 102 (3): 193-201, 2010. [PUBMED Abstract]
- Aretz S, Uhlhaas S, Goergens H, et al.: MUTYH-associated polyposis: 70 of 71 patients with biallelic mutations present with an attenuated or atypical phenotype. Int J Cancer 119 (4): 807-14, 2006. [PUBMED Abstract]
- Hearle N, Schumacher V, Menko FH, et al.: Frequency and spectrum of cancers in the Peutz-Jeghers syndrome. Clin Cancer Res 12 (10): 3209-15, 2006. [PUBMED Abstract]
- Coburn MC, Pricolo VE, DeLuca FG, et al.: Malignant potential in intestinal juvenile polyposis syndromes. Ann Surg Oncol 2 (5): 386-91, 1995. [PUBMED Abstract]
- Desai DC, Neale KF, Talbot IC, et al.: Juvenile polyposis. Br J Surg 82 (1): 14-7, 1995. [PUBMED Abstract]
- Bülow S, Berk T, Neale K: The history of familial adenomatous polyposis. Fam Cancer 5 (3): 213-20, 2006. [PUBMED Abstract]
- Herrera L, ed.: Familial Adenomatous Polyposis. Alan R. Liss Inc, 1990.
- Bülow S: Familial polyposis coli. Dan Med Bull 34 (1): 1-15, 1987. [PUBMED Abstract]
- Campbell WJ, Spence RA, Parks TG: Familial adenomatous polyposis. Br J Surg 81 (12): 1722-33, 1994. [PUBMED Abstract]
- Inra JA, Steyerberg EW, Grover S, et al.: Racial variation in frequency and phenotypes of APC and MUTYH mutations in 6,169 individuals undergoing genetic testing. Genet Med 17 (10): 815-21, 2015. [PUBMED Abstract]
- Giardiello FM, Offerhaus JG: Phenotype and cancer risk of various polyposis syndromes. Eur J Cancer 31A (7-8): 1085-7, 1995 Jul-Aug. [PUBMED Abstract]
- Jagelman DG, DeCosse JJ, Bussey HJ: Upper gastrointestinal cancer in familial adenomatous polyposis. Lancet 1 (8595): 1149-51, 1988. [PUBMED Abstract]
- Sturt NJ, Gallagher MC, Bassett P, et al.: Evidence for genetic predisposition to desmoid tumours in familial adenomatous polyposis independent of the germline APC mutation. Gut 53 (12): 1832-6, 2004. [PUBMED Abstract]
- Lynch HT, Fitzgibbons R: Surgery, desmoid tumors, and familial adenomatous polyposis: case report and literature review. Am J Gastroenterol 91 (12): 2598-601, 1996. [PUBMED Abstract]
- Bülow S, Björk J, Christensen IJ, et al.: Duodenal adenomatosis in familial adenomatous polyposis. Gut 53 (3): 381-6, 2004. [PUBMED Abstract]
- Burt RW: Colon cancer screening. Gastroenterology 119 (3): 837-53, 2000. [PUBMED Abstract]
- Galiatsatos P, Foulkes WD: Familial adenomatous polyposis. Am J Gastroenterol 101 (2): 385-98, 2006. [PUBMED Abstract]
- Bisgaard ML, Bülow S: Familial adenomatous polyposis (FAP): genotype correlation to FAP phenotype with osteomas and sebaceous cysts. Am J Med Genet A 140 (3): 200-4, 2006. [PUBMED Abstract]
- Petersen GM, Slack J, Nakamura Y: Screening guidelines and premorbid diagnosis of familial adenomatous polyposis using linkage. Gastroenterology 100 (6): 1658-64, 1991. [PUBMED Abstract]
- Berk T, Cohen Z, Bapat B, et al.: Negative genetic test result in familial adenomatous polyposis: clinical screening implications. Dis Colon Rectum 42 (3): 307-10; discussion 310-2, 1999. [PUBMED Abstract]
- Jagelman DG: Clinical management of familial adenomatous polyposis. Cancer Surv 8 (1): 159-67, 1989. [PUBMED Abstract]
- Neale K, Ritchie S, Thomson JP: Screening of offspring of patients with familial adenomatous polyposis: the St. Mark’s Hospital polyposis register experience. In: Herrera L, ed.: Familial Adenomatous Polyposis. Alan R. Liss Inc, 1990, pp 61-66.
- Nusliha A, Dalpatadu U, Amarasinghe B, et al.: Congenital hypertrophy of retinal pigment epithelium (CHRPE) in patients with familial adenomatous polyposis (FAP); a polyposis registry experience. BMC Res Notes 7: 734, 2014. [PUBMED Abstract]
- Chen CS, Phillips KD, Grist S, et al.: Congenital hypertrophy of the retinal pigment epithelium (CHRPE) in familial colorectal cancer. Fam Cancer 5 (4): 397-404, 2006. [PUBMED Abstract]
- Coleman P, Barnard NA: Congenital hypertrophy of the retinal pigment epithelium: prevalence and ocular features in the optometric population. Ophthalmic Physiol Opt 27 (6): 547-55, 2007. [PUBMED Abstract]
- Traboulsi EI, Apostolides J, Giardiello FM, et al.: Pigmented ocular fundus lesions and APC mutations in familial adenomatous polyposis. Ophthalmic Genet 17 (4): 167-74, 1996. [PUBMED Abstract]
- Anthony T, Rodriguez-Bigas MA, Weber TK, et al.: Desmoid tumors. J Am Coll Surg 182 (4): 369-77, 1996. [PUBMED Abstract]
- Eccles DM, van der Luijt R, Breukel C, et al.: Hereditary desmoid disease due to a frameshift mutation at codon 1924 of the APC gene. Am J Hum Genet 59 (6): 1193-201, 1996. [PUBMED Abstract]
- Bertario L, Russo A, Sala P, et al.: Genotype and phenotype factors as determinants of desmoid tumors in patients with familial adenomatous polyposis. Int J Cancer 95 (2): 102-7, 2001. [PUBMED Abstract]
- Lynch HT: Desmoid tumors: genotype-phenotype differences in familial adenomatous polyposis–a nosological dilemma. Am J Hum Genet 59 (6): 1184-5, 1996. [PUBMED Abstract]
- Scott RJ, Froggatt NJ, Trembath RC, et al.: Familial infiltrative fibromatosis (desmoid tumours) (MIM135290) caused by a recurrent 3′ APC gene mutation. Hum Mol Genet 5 (12): 1921-4, 1996. [PUBMED Abstract]
- Caspari R, Olschwang S, Friedl W, et al.: Familial adenomatous polyposis: desmoid tumours and lack of ophthalmic lesions (CHRPE) associated with APC mutations beyond codon 1444. Hum Mol Genet 4 (3): 337-40, 1995. [PUBMED Abstract]
- Davies DR, Armstrong JG, Thakker N, et al.: Severe Gardner syndrome in families with mutations restricted to a specific region of the APC gene. Am J Hum Genet 57 (5): 1151-8, 1995. [PUBMED Abstract]
- Bertario L, Russo A, Sala P, et al.: Multiple approach to the exploration of genotype-phenotype correlations in familial adenomatous polyposis. J Clin Oncol 21 (9): 1698-707, 2003. [PUBMED Abstract]
- Elayi E, Manilich E, Church J: Polishing the crystal ball: knowing genotype improves ability to predict desmoid disease in patients with familial adenomatous polyposis. Dis Colon Rectum 52 (10): 1762-6, 2009. [PUBMED Abstract]
- Nieuwenhuis MH, Lefevre JH, Bülow S, et al.: Family history, surgery, and APC mutation are risk factors for desmoid tumors in familial adenomatous polyposis: an international cohort study. Dis Colon Rectum 54 (10): 1229-34, 2011. [PUBMED Abstract]
- Clark SK, Smith TG, Katz DE, et al.: Identification and progression of a desmoid precursor lesion in patients with familial adenomatous polyposis. Br J Surg 85 (7): 970-3, 1998. [PUBMED Abstract]
- Hodgson SV, Maher ER: Gastro-intestinal system. In: Hodgson SV, Maher ER: A Practical Guide to Human Cancer Genetics. 2nd ed. Cambridge University Press, 1999, pp 167-175.
- Rodriguez-Bigas MA, Mahoney MC, Karakousis CP, et al.: Desmoid tumors in patients with familial adenomatous polyposis. Cancer 74 (4): 1270-4, 1994. [PUBMED Abstract]
- Clark SK, Neale KF, Landgrebe JC, et al.: Desmoid tumours complicating familial adenomatous polyposis. Br J Surg 86 (9): 1185-9, 1999. [PUBMED Abstract]
- Belchetz LA, Berk T, Bapat BV, et al.: Changing causes of mortality in patients with familial adenomatous polyposis. Dis Colon Rectum 39 (4): 384-7, 1996. [PUBMED Abstract]
- Iwama T, Tamura K, Morita T, et al.: A clinical overview of familial adenomatous polyposis derived from the database of the Polyposis Registry of Japan. Int J Clin Oncol 9 (4): 308-16, 2004. [PUBMED Abstract]
- Church J, Berk T, Boman BM, et al.: Staging intra-abdominal desmoid tumors in familial adenomatous polyposis: a search for a uniform approach to a troubling disease. Dis Colon Rectum 48 (8): 1528-34, 2005. [PUBMED Abstract]
- Parc Y, Piquard A, Dozois RR, et al.: Long-term outcome of familial adenomatous polyposis patients after restorative coloproctectomy. Ann Surg 239 (3): 378-82, 2004. [PUBMED Abstract]
- Church JM, McGannon E, Hull-Boiner S, et al.: Gastroduodenal polyps in patients with familial adenomatous polyposis. Dis Colon Rectum 35 (12): 1170-3, 1992. [PUBMED Abstract]
- Sarre RG, Frost AG, Jagelman DG, et al.: Gastric and duodenal polyps in familial adenomatous polyposis: a prospective study of the nature and prevalence of upper gastrointestinal polyps. Gut 28 (3): 306-14, 1987. [PUBMED Abstract]
- Watanabe H, Enjoji M, Yao T, et al.: Gastric lesions in familial adenomatosis coli: their incidence and histologic analysis. Hum Pathol 9 (3): 269-83, 1978. [PUBMED Abstract]
- Weston BR, Helper DJ, Rex DK: Positive predictive value of endoscopic features deemed typical of gastric fundic gland polyps. J Clin Gastroenterol 36 (5): 399-402, 2003 May-Jun. [PUBMED Abstract]
- Abraham SC, Nobukawa B, Giardiello FM, et al.: Fundic gland polyps in familial adenomatous polyposis: neoplasms with frequent somatic adenomatous polyposis coli gene alterations. Am J Pathol 157 (3): 747-54, 2000. [PUBMED Abstract]
- Odze RD, Marcial MA, Antonioli D: Gastric fundic gland polyps: a morphological study including mucin histochemistry, stereometry, and MIB-1 immunohistochemistry. Hum Pathol 27 (9): 896-903, 1996. [PUBMED Abstract]
- Wu TT, Kornacki S, Rashid A, et al.: Dysplasia and dysregulation of proliferation in foveolar and surface epithelia of fundic gland polyps from patients with familial adenomatous polyposis. Am J Surg Pathol 22 (3): 293-8, 1998. [PUBMED Abstract]
- Burt RW: Gastric fundic gland polyps. Gastroenterology 125 (5): 1462-9, 2003. [PUBMED Abstract]
- Bianchi LK, Burke CA, Bennett AE, et al.: Fundic gland polyp dysplasia is common in familial adenomatous polyposis. Clin Gastroenterol Hepatol 6 (2): 180-5, 2008. [PUBMED Abstract]
- Jalving M, Koornstra JJ, Wesseling J, et al.: Increased risk of fundic gland polyps during long-term proton pump inhibitor therapy. Aliment Pharmacol Ther 24 (9): 1341-8, 2006. [PUBMED Abstract]
- Leggett B: FAP: another indication to treat H pylori. Gut 51 (4): 463-4, 2002. [PUBMED Abstract]
- Nakamura S, Matsumoto T, Kobori Y, et al.: Impact of Helicobacter pylori infection and mucosal atrophy on gastric lesions in patients with familial adenomatous polyposis. Gut 51 (4): 485-9, 2002. [PUBMED Abstract]
- Iida M, Yao T, Itoh H, et al.: Natural history of gastric adenomas in patients with familial adenomatosis coli/Gardner’s syndrome. Cancer 61 (3): 605-11, 1988. [PUBMED Abstract]
- Bülow S, Alm T, Fausa O, et al.: Duodenal adenomatosis in familial adenomatous polyposis. DAF Project Group. Int J Colorectal Dis 10 (1): 43-6, 1995. [PUBMED Abstract]
- Park JG, Park KJ, Ahn YO, et al.: Risk of gastric cancer among Korean familial adenomatous polyposis patients. Report of three cases. Dis Colon Rectum 35 (10): 996-8, 1992. [PUBMED Abstract]
- Iwama T, Mishima Y, Utsunomiya J: The impact of familial adenomatous polyposis on the tumorigenesis and mortality at the several organs. Its rational treatment. Ann Surg 217 (2): 101-8, 1993. [PUBMED Abstract]
- Offerhaus GJ, Giardiello FM, Krush AJ, et al.: The risk of upper gastrointestinal cancer in familial adenomatous polyposis. Gastroenterology 102 (6): 1980-2, 1992. [PUBMED Abstract]
- Brosens LA, Keller JJ, Offerhaus GJ, et al.: Prevention and management of duodenal polyps in familial adenomatous polyposis. Gut 54 (7): 1034-43, 2005. [PUBMED Abstract]
- Ngamruengphong S, Boardman LA, Heigh RI, et al.: Gastric adenomas in familial adenomatous polyposis are common, but subtle, and have a benign course. Hered Cancer Clin Pract 12 (1): 4, 2014. [PUBMED Abstract]
- Mankaney G, Leone P, Cruise M, et al.: Gastric cancer in FAP: a concerning rise in incidence. Fam Cancer 16 (3): 371-376, 2017. [PUBMED Abstract]
- Li J, Woods SL, Healey S, et al.: Point Mutations in Exon 1B of APC Reveal Gastric Adenocarcinoma and Proximal Polyposis of the Stomach as a Familial Adenomatous Polyposis Variant. Am J Hum Genet 98 (5): 830-842, 2016. [PUBMED Abstract]
- Perzin KH, Bridge MF: Adenomas of the small intestine: a clinicopathologic review of 51 cases and a study of their relationship to carcinoma. Cancer 48 (3): 799-819, 1981. [PUBMED Abstract]
- Ranzi T, Castagnone D, Velio P, et al.: Gastric and duodenal polyps in familial polyposis coli. Gut 22 (5): 363-7, 1981. [PUBMED Abstract]
- Burke CA, Santisi J, Church J, et al.: The utility of capsule endoscopy small bowel surveillance in patients with polyposis. Am J Gastroenterol 100 (7): 1498-502, 2005. [PUBMED Abstract]
- Tescher P, Macrae FA, Speer T, et al.: Surveillance of FAP: a prospective blinded comparison of capsule endoscopy and other GI imaging to detect small bowel polyps. Hered Cancer Clin Pract 8 (1): 3, 2010. [PUBMED Abstract]
- Eliakim R: Video capsule endoscopy of the small bowel. Curr Opin Gastroenterol 26 (2): 129-33, 2010. [PUBMED Abstract]
- Taylor SA, Halligan S, Moore L, et al.: Multidetector-row CT duodenography in familial adenomatous polyposis: a pilot study. Clin Radiol 59 (10): 939-45, 2004. [PUBMED Abstract]
- Vasen HF, Bülow S, Myrhøj T, et al.: Decision analysis in the management of duodenal adenomatosis in familial adenomatous polyposis. Gut 40 (6): 716-9, 1997. [PUBMED Abstract]
- Groves CJ, Saunders BP, Spigelman AD, et al.: Duodenal cancer in patients with familial adenomatous polyposis (FAP): results of a 10 year prospective study. Gut 50 (5): 636-41, 2002. [PUBMED Abstract]
- Aparicio T, Henriques J, Manfredi S, et al.: Small bowel adenocarcinoma: Results from a nationwide prospective ARCAD-NADEGE cohort study of 347 patients. Int J Cancer 147 (4): 967-977, 2020. [PUBMED Abstract]
- Bleau BL, Gostout CJ: Endoscopic treatment of ampullary adenomas in familial adenomatous polyposis. J Clin Gastroenterol 22 (3): 237-41, 1996. [PUBMED Abstract]
- Norton ID, Gostout CJ: Management of periampullary adenoma. Dig Dis 16 (5): 266-73, 1998 Sep-Oct. [PUBMED Abstract]
- Norton ID, Gostout CJ, Baron TH, et al.: Safety and outcome of endoscopic snare excision of the major duodenal papilla. Gastrointest Endosc 56 (2): 239-43, 2002. [PUBMED Abstract]
- Saurin JC, Gutknecht C, Napoleon B, et al.: Surveillance of duodenal adenomas in familial adenomatous polyposis reveals high cumulative risk of advanced disease. J Clin Oncol 22 (3): 493-8, 2004. [PUBMED Abstract]
- Spigelman AD, Williams CB, Talbot IC, et al.: Upper gastrointestinal cancer in patients with familial adenomatous polyposis. Lancet 2 (8666): 783-5, 1989. [PUBMED Abstract]
- Thiruvengadam SS, Lopez R, O’Malley M, et al.: Spigelman stage IV duodenal polyposis does not precede most duodenal cancer cases in patients with familial adenomatous polyposis. Gastrointest Endosc 89 (2): 345-354.e2, 2019. [PUBMED Abstract]
- Cetta F, Montalto G, Gori M, et al.: Germline mutations of the APC gene in patients with familial adenomatous polyposis-associated thyroid carcinoma: results from a European cooperative study. J Clin Endocrinol Metab 85 (1): 286-92, 2000. [PUBMED Abstract]
- Cetta F, Curia MC, Montalto G, et al.: Thyroid carcinoma usually occurs in patients with familial adenomatous polyposis in the absence of biallelic inactivation of the adenomatous polyposis coli gene. J Clin Endocrinol Metab 86 (1): 427-32, 2001. [PUBMED Abstract]
- Seki M, Tanaka K, Kikuchi-Yanoshita R, et al.: Loss of normal allele of the APC gene in an adrenocortical carcinoma from a patient with familial adenomatous polyposis. Hum Genet 89 (3): 298-300, 1992. [PUBMED Abstract]
- Marchesa P, Fazio VW, Church JM, et al.: Adrenal masses in patients with familial adenomatous polyposis. Dis Colon Rectum 40 (9): 1023-8, 1997. [PUBMED Abstract]
- Kallenberg FGJ, Bastiaansen BAJ, Nio CY, et al.: Adrenal Lesions in Patients With (Attenuated) Familial Adenomatous Polyposis and MUTYH-Associated Polyposis. Dis Colon Rectum 60 (10): 1057-1064, 2017. [PUBMED Abstract]
- Cetta F, Mazzarella L, Bon G, et al.: Genetic alterations in hepatoblastoma and hepatocellular carcinoma associated with familial adenomatous polyposis. Med Pediatr Oncol 41 (5): 496-7, 2003. [PUBMED Abstract]
- Young J, Barker M, Robertson T, et al.: A case of myoepithelial carcinoma displaying biallelic inactivation of the tumour suppressor gene APC in a patient with familial adenomatous polyposis. J Clin Pathol 55 (3): 230-1, 2002. [PUBMED Abstract]
- Cetta F, Montalto G, Petracci M: Hepatoblastoma and APC gene mutation in familial adenomatous polyposis. Gut 41 (3): 417, 1997. [PUBMED Abstract]
- Giardiello FM, Petersen GM, Brensinger JD, et al.: Hepatoblastoma and APC gene mutation in familial adenomatous polyposis. Gut 39 (96): 867-9, 1996. [PUBMED Abstract]
- Ding SF, Michail NE, Habib NA: Genetic changes in hepatoblastoma. J Hepatol 20 (5): 672-5, 1994. [PUBMED Abstract]
- Hughes LJ, Michels VV: Risk of hepatoblastoma in familial adenomatous polyposis. Am J Med Genet 43 (6): 1023-5, 1992. [PUBMED Abstract]
- Bernstein IT, Bülow S, Mauritzen K: Hepatoblastoma in two cousins in a family with adenomatous polyposis. Report of two cases. Dis Colon Rectum 35 (4): 373-4, 1992. [PUBMED Abstract]
- Giardiello FM, Offerhaus GJ, Krush AJ, et al.: Risk of hepatoblastoma in familial adenomatous polyposis. J Pediatr 119 (5): 766-8, 1991. [PUBMED Abstract]
- Perilongo G: Link confirmed between FAP and hepatoblastoma. Oncology (Huntingt) 5 (7): 14, 1991. [PUBMED Abstract]
- Toyama WM, Wagner S: Hepatoblastoma with familial polyposis coli: another case and corrected pedigree. Surgery 108 (1): 123-4, 1990. [PUBMED Abstract]
- Kurahashi H, Takami K, Oue T, et al.: Biallelic inactivation of the APC gene in hepatoblastoma. Cancer Res 55 (21): 5007-11, 1995. [PUBMED Abstract]
- Hirschman BA, Pollock BH, Tomlinson GE: The spectrum of APC mutations in children with hepatoblastoma from familial adenomatous polyposis kindreds. J Pediatr 147 (2): 263-6, 2005. [PUBMED Abstract]
- Hamilton SR, Liu B, Parsons RE, et al.: The molecular basis of Turcot’s syndrome. N Engl J Med 332 (13): 839-47, 1995. [PUBMED Abstract]