آنچه در این مطلب خواهید خواند
- چاقی چیست؟
- اضافه وزن و چاقی چقدر شایع است؟
- در مورد رابطه بین اضافه وزن و چاقی و سرطان چه می دانیم؟
- چاقی چگونه ممکن است خطر ابتلا به سرطان را افزایش دهد؟
- چه تعداد از موارد سرطان ممکن است به دلیل وزن اضافی بدن باشد؟
- آیا کاهش وزن خطر ابتلا به سرطان را کاهش میدهد؟
- چاقی چه تاثیری بر بازماندگان سرطان دارد؟
- آیا کاهش وزن پس از تشخیص سرطان برای افراد دارای اضافه وزن یا چاقی مفید است؟
- چه تحقیقاتی در مورد چاقی و سرطان انجام میشود؟
چاقی چیست؟
چاقی بیماری است که در آن فرد مقدار و/یا توزیع چربی بدن ناسالمی دارد (1). در مقایسه با افراد با وزن سالم، افراد دارای اضافه وزن یا چاقی در معرض خطر بیشتری برای بسیاری از بیماریها از جمله دیابت، فشار خون بالا، بیماریهای قلبی عروقی، سکته مغزی و حداقل 13 نوع سرطان و همچنین خطر بالای مرگ ناشی از همه علل هستند (2–5).
برای تعیین سطح چربی بدن یک فرد، پزشکان معمولاً از معیاری به نام شاخص توده بدنی (BMI) استفاده میکنند. BMI با تقسیم وزن فرد (به کیلوگرم) بر قد او (به متر) به توان دو (که معمولاً به صورت کیلوگرم بر متر مربع بیان میشود) محاسبه میشود. BMI معیار مستقیمی برای چربی بدن نیست، اما ارزیابی دقیقتری از چاقی نسبت به وزن به تنهایی ارائه میدهد. این یک تخمین مفید از چربی بدن در جمعیتها است، اما نمیتوان آن را به تنهایی برای نشان دادن خطرات بیماریهای مرتبط با چاقی در افراد استفاده کرد (6).
موسسه ملی قلب، ریه و خون یک محاسبهگر BMI برای بزرگسالان دارد. دستههای وزنی استاندارد بر اساس BMI برای بزرگسالان ۲۰ سال یا بالاتر عبارتند از:
| شاخص توده بدنی (BMI) بر حسب کیلوگرم بر متر مربع | دسته وزنی |
|---|---|
| زیر ۱۸.۵ | کمبود وزن |
| ۱۸.۵ تا ۲۴.۹ | سالم |
| ۲۵.۰ تا ۲۹.۹ | اضافه وزن |
| ۳۰.۰ تا ۳۹.۹ | چاق |
| ۴۰.۰ یا بالاتر | چاقی شدید |
مراکز کنترل و پیشگیری از بیماریها (CDC) یک محاسبهگر درصد BMI برای کودکان و نوجوانان دارد. اضافه وزن و چاقی برای افراد زیر 20 سال، که BMI آنها میتواند با رشد به طور قابل توجهی تغییر کند، بر اساس نمودارهای رشد BMI برای سن CDC محاسبه میشود.
| شاخص توده بدنی (BMI) | دسته وزنی |
|---|---|
| شاخص توده بدنی برای سن کمتر از صدک پنجم مختص جنس | کمبود وزن |
| شاخص توده بدنی برای سن در صدک پنجم یا بالاتر از صدک ۸۵ مخصوص جنس، اما کمتر از صدک ۸۵ | سالم |
| شاخص توده بدنی برای سن در صدک ۸۵ مخصوص جنس یا بالاتر، اما کمتر از صدک ۹۵ | اضافه وزن |
| شاخص توده بدنی برای سن در صدک ۹۵ مخصوص جنس یا بالاتر | چاق |
| شاخص توده بدنی برای سن در 120٪ یا بالاتر از صدک 95 مخصوص جنس* | چاقی شدید |
| *بر اساس توصیههای متخصصان (7) |
اندازهگیریهایی که توزیع چربی بدن را نشان میدهند، گاهی اوقات همراه با BMI به عنوان شاخصهای چاقی و خطرات بیماری استفاده میشوند. این اندازهگیریها شامل دور کمر، نسبت دور کمر به باسن (دور کمر تقسیم بر دور باسن)، نسبت دور کمر به قد و توزیع چربی است که با جذبسنجی اشعه ایکس با انرژی دوگانه (DXA یا DEXA)، تصویربرداری با CT یا PET یا اندازهگیریهای شکل بدن اندازهگیری میشود (8).
این معیارها به این دلیل استفاده میشوند که توزیع چربی به طور فزایندهای با خطرات بیماری مرتبط دانسته میشود. به طور خاص، چربی احشایی-چربی که اندامهای داخلی را احاطه کرده است- از نظر خطرات بیماری، خطرناکتر از چربی کلی یا چربی زیر جلدی (لایهای که درست زیر پوست قرار دارد) به نظر میرسد.
اضافه وزن و چاقی چقدر شایع است؟
در ایران شیوع ترکیبی اضافهوزن به اضافه چاقی: تقریباً ۳۵٫۰۹٪ در کل جمعیت برآورد شده است. میزان شیوع چاقی (BMI ≥ ۳۰) در کل کشور ~ ۱۳٫۴۴٪ و در بزرگسالان حدود ۲۱٫۳۸٪ گزارش شده است. زنان به طور مکرر شیوع بالاتری از چاقی نسبت به مردان دارند.
شیوع چاقی در ایالات متحده در بین گروههای نژادی و قومی متفاوت است (9). در سال 2023، طبق گزارش CDC، نسبت بزرگسالان 18 سال یا بالاتر مبتلا به چاقی به شرح زیر بود:
- سیاهپوست غیر اسپانیاییتبار، ۴۲.۰٪
- سرخپوست آمریکایی/بومی آلاسکا، ۳۹.۶٪
- اهل هاوایی/جزیرهنشین اقیانوس آرام، ۳۱.۸٪
- اسپانیایی تبار، ۳۵.۱٪
- سفیدپوست غیر اسپانیایی تبار، ۳۲.۲٪
- آسیایی، ۱۳.۴٪
تجزیه و تحلیل تغییرات شیوع اضافه وزن و چاقی در ایالات متحده از سال 1990 تا 2021 نشان داد که این بیماری در تمام گروههای سنی مورد بررسی افزایش یافته است (10).
در مورد رابطه بین اضافه وزن و چاقی و سرطان چه می دانیم؟
بهترین شواهد مربوط به ارتباط اضافه وزن و چاقی با خطر ابتلا به سرطان از مطالعات کوهورت بزرگ، نوعی مطالعه مشاهدهای، به دست آمده است.
یک گروه کاری آژانس بینالمللی تحقیقات سرطان بر اساس بررسی بیش از ۱۰۰۰ مطالعه از این دست، نتیجه گرفته شد که شواهد محکمی وجود دارد که نشان میدهد مقادیر بالاتر چربی بدن با افزایش خطر ابتلا به تعدادی از سرطانها مرتبط است. سرطانهایی که مشخص شده است با چاقی یا اضافه وزن مرتبط هستند عبارتند از:
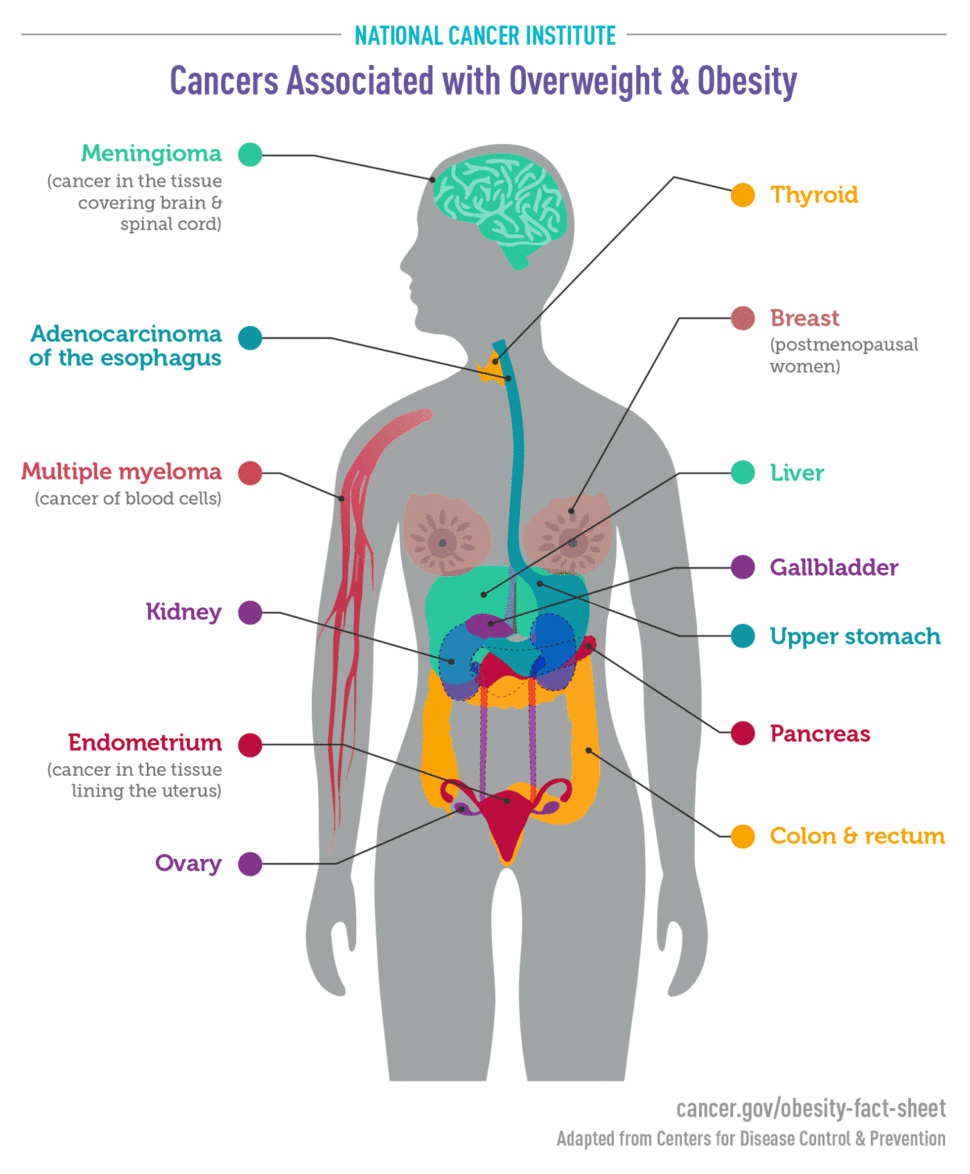
- آندومتر (11، 12)
- مری (13)
- بالای معده (14)
- کبد (15، 16)
- کلیه ( 17، 18)
- میلوما چندگانه (19)
- مننژیوم (20)
- پانکراس (21)
- کولورکتال (22)
- کیسه صفرا (23، 24)
- پستان (پس از یائسگی) (25، 26)
- تخمدان (27، 28)
- تیروئید (29)
افزایش خطر مرتبط با چاقی در سرطانهای آندومتر و مری بیشترین میزان را دارد.
- برای سرطانهای آندومتر نوع ۱ (آنهایی که با استروژن اضافی مرتبط هستند)، افرادی که چاقی شدید دارند، در مقایسه با افراد با وزن سالم، حدود هفت برابر و افرادی که اضافه وزن یا چاقی دارند، دو تا چهار برابر بیشتر در معرض خطر هستند.
- در مورد سرطان مری، افراد مبتلا به چاقی شدید تقریباً پنج برابر و افراد چاق بیش از دو برابر افراد با وزن سالم در معرض خطر ابتلا به این بیماری هستند.
- برای سایر انواع سرطان مرتبط با چاقی، افزایش خطر در افراد چاق از حدود ۱۰٪ افزایش خطر تا دو برابر شدن خطر متغیر است.
یک مطالعه اخیر روی بیش از 2 میلیون نفر در اسپانیا که به طور متوسط 9 سال پیگیری شدند، شواهدی را نشان داد که اضافه وزن و چاقی با 18 سرطان مرتبط هستند، از جمله برخی که هنوز به عنوان مرتبط با چاقی در نظر گرفته نشدهاند (30).
افرادی که در زمان تشخیص سرطان، شاخص توده بدنی (BMI) بالاتری دارند، در آینده در معرض خطر بیشتری برای ابتلا به سرطان اولیه دوم (سرطانی که به سرطان اول مرتبط نیست) هستند (31-34).
چاقی چگونه ممکن است خطر ابتلا به سرطان را افزایش دهد؟
چندین مکانیسم احتمالی برای توضیح چگونگی افزایش خطر ابتلا به برخی سرطانها توسط چاقی پیشنهاد شده است (35، 36).
- بافت چربی (که بافت چربی نیز نامیده میشود) مقادیر اضافی استروژن تولید میکند که به عنوان عامل سرطان شناخته میشود. سطوح بالای استروژن با افزایش خطر ابتلا به سرطان پستان، آندومتر، تخمدان و برخی دیگر از سرطانها مرتبط است.
- افراد چاق اغلب سطح انسولین و فاکتور رشد شبه انسولین-1 (IGF-1) خونشان افزایش مییابد. سطح بالای انسولین، وضعیتی که به عنوان هایپرانسولینمی شناخته میشود، به دلیل مقاومت به انسولین است و مقدمهای بر ابتلا به دیابت نوع 2، یکی دیگر از عوامل خطر شناخته شده سرطان، میباشد. سطح بالای انسولین و IGF-1 با افزایش خطر ابتلا به سرطانهای روده بزرگ، تیروئید، پستان، پروستات، تخمدان و آندومتر مرتبط است (37، 38).
- افراد چاق اغلب التهاب مزمن دارند که مستقیماً از طریق چندین مکانیسم باعث رشد تومور میشود (39).
- سلولهای چربی هورمونهایی به نام آدیپوکین تولید میکنند که میتوانند رشد سلول را تحریک یا مهار کنند (40). به عنوان مثال، سطح خونی آدیپوکینی به نام لپتین با افزایش چربی بدن افزایش مییابد و سطح بالای لپتین میتواند تکثیر سلولی غیرطبیعی را افزایش دهد. آدیپوکین دیگری به نام آدیپونکتین که ممکن است اثرات ضد تکثیری داشته باشد و از رشد تومور محافظت کند، در افراد چاق کمتر از افراد با وزن سالم وجود دارد.
- سلولهای چربی همچنین ممکن است اثرات مستقیم و غیرمستقیمی بر سایر تنظیمکنندههای رشد سلولی و متابولیک داشته باشند. این تنظیمکنندهها شامل هدف راپامایسین پستانداران (mTOR) و پروتئین کیناز فعالشده با AMP هستند که هر دو در تنظیم اتوفاژی نقش دارند، که اختلال در آن میتواند منجر به سرطان شود (41).
سایر مکانیسمهای احتمالی که چاقی میتواند از طریق آنها بر خطر ابتلا به سرطان تأثیر بگذارد شامل اثر مکانیکی بر اسفنکتر تحتانی مری است که باعث ایجاد بیماری رفلاکس معده به مری (یک عامل خطر برای آدنوکارسینوم مری) میشود؛ اختلال در ایمنی تومور؛ و تغییرات در ساختار بافتی که تومورهای در حال توسعه را احاطه کرده است (42، 43).
علاوه بر اثرات بیولوژیکی، چاقی میتواند منجر به چالشهایی در غربالگری و مدیریت شود. به عنوان مثال، زنان دارای اضافه وزن یا چاقی در مقایسه با زنان دارای وزن سالم، خطر ابتلا به سرطان دهانه رحم بیشتری دارند، احتمالاً به این دلیل که غربالگری سرطان دهانه رحم در این افراد کمتر مؤثر است (44).
چه تعداد از موارد سرطان ممکن است به دلیل وزن اضافی بدن باشد؟
مطالعهای که از دادههای ملی در مورد میزان بروز و مرگ و میر ناشی از سرطان و شیوع عوامل خطر استفاده کرد، تخمین زد که در سال 2019 در بین افراد 30 سال و بالاتر در ایالات متحده، حدود 43720 مورد جدید سرطان در مردان (4.8٪) و 92200 مورد جدید سرطان در زنان (10.6٪) به دلیل وزن اضافی بدن (اضافه وزن و چاقی) بوده است (45). درصد موارد منتسب به وزن اضافی بدن در انواع سرطان بسیار متفاوت بود و برای سرطان کبد 34.9٪ و برای سرطان آندومتر 53.1٪ در زنان و برای سرطان کیسه صفرا 37.1٪ و برای آدنوکارسینوم مری 37.8٪ در مردان بود.
یک مطالعه در سال 2024 بررسی کرد که آیا افزایش بروز سرطانهای زودرس در طول دوره 2000 تا 2012 در سراسر جهان را میتوان با افزایش میزان چاقی در بین بزرگسالان جوان در این دوره توضیح داد (46). شش مورد از نه سرطان مرتبط با چاقی در این دوره در بین بزرگسالان جوان افزایش یافته است و برای چهار مورد از این سرطانها (روده بزرگ، رکتوم، پانکراس و کلیه)، این افزایش با افزایش وزن بدن همراه بوده است. این یافته نشان دهنده ارتباط احتمالی بین اپیدمی چاقی و افزایش بروز این سرطانهای زودرس در سراسر جهان است (46). چاقی همچنین با افزایش خطرات سرطان سینه زودرس در زنان سیاه پوست مرتبط بوده است (47، 48).
آیا کاهش وزن خطر ابتلا به سرطان را کاهش میدهد؟
بیشتر دادهها در مورد اینکه آیا کاهش وزن خطر ابتلا به سرطان را کاهش میدهد یا خیر، از مطالعات مشاهدهای مانند مطالعات کوهورت و مورد-شاهدی به دست میآید. مطالعات تصادفی کنترلشده در مورد رژیمهای غذایی کاهش وزن انجام شده است، اما گاهی اوقات نتوانستهاند تغییر وزن قابل توجهی ایجاد کنند و به نظر نمیرسد که خطر ابتلا به سرطان را کاهش دهند (49). مطالعات مشاهدهای در مورد کاهش وزن و خطر ابتلا به سرطان باید با احتیاط تفسیر شوند، زیرا تفاوتهای دیگر بین افرادی که وزن کم میکنند و افرادی که وزن کم نمیکنند، ممکن است دلیل تفاوت در خطر ابتلا به سرطان در آنها باشد.
برخی از این مطالعات، کاهش خطر ابتلا به سرطانهای پستان، آندومتر، روده بزرگ و پروستات را در بین افراد چاق که وزن کم کرده بودند، نشان دادهاند. به عنوان مثال، در یک مطالعه آیندهنگر بزرگ روی زنان یائسه، افرادی که عمداً بیش از 5٪ از وزن بدن خود را کاهش داده بودند، خطر ابتلا به سرطانهای مرتبط با چاقی، به ویژه سرطان آندومتر، در آنها کمتر بود (50).
و در میان زنان یائسه در مطالعه مشاهدهای ابتکار سلامت زنان، افرادی که حداقل 5٪ از وزن بدن خود را در طول دوره پیگیری مطالعه از دست داده بودند، نسبت به افرادی که وزنشان پایدار بود، خطر ابتلا به سرطان تهاجمی پستان کمتری داشتند (51). همچنین، نتایج مطالعهای که دادههای 10 گروه را جمعآوری کرده بود، نشان داد که کاهش وزن پایدار با کاهش خطر سرطان پستان در زنان 50 سال و بالاتر مرتبط است (52).
کاهش وزن از طریق جراحی چاقی (جراحی که روی معده یا روده انجام میشود تا حداکثر و پایدارترین کاهش وزن را فراهم کند) نیز با کاهش خطر ابتلا به سرطان مرتبط است (53). مطالعات نشان دادهاند که افراد چاق، به ویژه زنانی که جراحی چاقی انجام دادهاند، در مجموع خطر ابتلا به سرطان (54)؛ سرطانهای مرتبط با هورمون، مانند سرطان پستان (55)، سرطان آندومتر و سرطان پروستات (56)؛ و سرطانهای مرتبط با چاقی، مانند سرطان پستان پس از یائسگی، سرطان آندومتر، سرطان مری، معده و سرطان روده بزرگ (57-59) کمتری دارند.
کاهش وزن از طریق داروهای تأیید شده برای درمان چاقی (از جمله آگونیستهای گیرنده GLP-1 تیرزپاتید، سماگلوتید و لیراگلوتید) نیز با کاهش خطر برخی از سرطانهای مرتبط با چاقی مرتبط بوده است. به عنوان مثال، در یک مطالعه کوهورت گذشتهنگر بزرگ در سراسر کشور، افراد مبتلا به دیابت نوع 2 بدون تشخیص قبلی سرطان مرتبط با چاقی که آگونیستهای گیرنده GLP-1 برایشان تجویز شده بود، خطر ابتلا به 10 مورد از 13 سرطان مرتبط با چاقی، از جمله سرطانهای مری، روده بزرگ، کلیه، پانکراس، کیسه صفرا، تخمدان، آندومتر و کبد و همچنین مننژیوم و میلوما چندگانه را کاهش دادند (60). با این حال، یک متاآنالیز از کارآزماییهای تصادفی کنترلشده با میانگین 3 سال پیگیری برای هر شرکتکننده، هیچ ارتباطی بین آگونیستهای گیرنده GLP-1 و خطر ابتلا به هیچ سرطان دستگاه گوارش، از جمله سرطانهای روده بزرگ، پانکراس، کبد یا کیسه صفرا، پیدا نکرد (61).
چاقی چه تاثیری بر بازماندگان سرطان دارد؟
بیشتر شواهد مربوط به چاقی در بازماندگان سرطان از افرادی به دست آمده است که به سرطان پستان، پروستات یا روده بزرگ مبتلا شدهاند. تحقیقات نشان میدهد که چاقی ممکن است چندین جنبه از بقای سرطان، از جمله کیفیت زندگی، عود سرطان، پیشرفت سرطان ، پیشآگهی (بقا) و خطر ابتلا به برخی سرطانهای ثانویه اولیه را بدتر کند (31، 32، 34، 62، 63).
برای مثال، چاقی با افزایش خطر ابتلا به لنف ادم مرتبط با درمان در بازماندگان سرطان پستان (64) و بیاختیاری در بازماندگان سرطان پروستات که با پروستاتکتومی رادیکال درمان شدهاند (65) مرتبط است. در یک کارآزمایی بالینی بزرگ روی بیماران مبتلا به سرطان رکتوم مرحله II و III، افرادی که BMI پایه بالاتری داشتند (به ویژه مردان) خطر عود موضعی بیشتری داشتند (66). در یک تجزیه و تحلیل بزرگ که شامل 1.5 میلیون نفر مبتلا به مولتیپل میلوما بود، افرادی که بالاترین میزان چاقی را داشتند، 50٪ بیشتر از افرادی که وزن سالم داشتند، در اثر بیماری خود فوت کردند (67).
آیا کاهش وزن پس از تشخیص سرطان برای افراد دارای اضافه وزن یا چاقی مفید است؟
بیشتر مطالعات در مورد چگونگی تأثیر کاهش وزن بر پیامدها در افراد مبتلا به سرطان، بر سرطان پستان متمرکز شدهاند. چندین کارآزمایی بالینی تصادفی در بازماندگان سرطان پستان گزارش دادهاند که مداخلات کاهش وزن منجر به کاهش وزن و تغییرات مفید در نشانگرهای زیستی مرتبط با ارتباط بین چاقی و پیشآگهی بیماری شده است ( 68، 69).
با این حال، شواهد کمی در مورد اینکه آیا کاهش وزن خطر عود سرطان پستان یا مرگ ناشی از آن را کاهش میدهد یا خیر، وجود دارد ( 70 ). مطالعه کاهش وزن سرطان پستان (BWEL) که توسط NCI حمایت میشود، یک کارآزمایی تصادفی فاز 3 در حال انجام است، در حال بررسی این موضوع است که آیا شرکت در یک برنامه کاهش وزن پس از تشخیص سرطان پستان، خطر عود بیماری را در بین زنان دارای اضافه وزن و چاق کاهش میدهد یا خیر (71).
چه تحقیقاتی در مورد چاقی و سرطان انجام میشود؟
علاوه بر مطالعات مربوط به مکانیسمهایی که چاقی از طریق آنها بر خطر سرطان تأثیر میگذارد، محققان در حال بررسی این موضوع هستند که آیا این ارتباط بر اساس نژاد یا قومیت متفاوت است یا خیر (72). همچنین، محققان در حال بررسی این موضوع هستند که آیا باید از حد آستانههای مختلف برای اضافه وزن و چاقی برای گروههای نژادی/قومی مختلف استفاده شود یا خیر. به عنوان مثال، سازمان بهداشت جهانی (WHO) آستانههای متناوب 23.0 و 27.5 کیلوگرم بر متر مربع را برای اضافه وزن و چاقی برای افراد با نژاد آسیایی پیشنهاد کرده است (73).
کنسرسیوم کوهورت NCI یک همکاری برون دانشگاهی-درون دانشگاهی است که بیش از ۵۰ مطالعه کوهورت آیندهنگر از سراسر جهان را با بیش از ۷ میلیون شرکتکننده ترکیب میکند. این مطالعات در حال جمعآوری اطلاعات در مورد رژیم غذایی و فعالیت بدنی و شاخص توده بدنی، دور کمر و سایر معیارهای چاقی از هر گروه هستند. اندازه بزرگ این کنسرسیوم به محققان این امکان را میدهد تا درک بهتری از چگونگی ارتباط عوامل مرتبط با چاقی با سرطانهای کمتر شایع، مانند سرطانهای تیروئید، کیسه صفرا، سر و گردن و کلیه، به دست آورند.
یکی دیگر از حوزههای مطالعاتی بر توسعه مداخلات دقیقتر و مؤثرتر برای جلوگیری از افزایش وزن و بازگشت وزن پس از کاهش وزن متمرکز است. این حوزه تحقیقاتی شامل دو طرح مبتنی بر NIH است-اقدامات اصلی جمعآوری دادهها برای پیشبینی بهینه درمان چاقی (ADOPT) و کنسرسیوم Trans-NIH از کارآزماییهای کنترلشده تصادفی مداخلات کاهش وزن سبک زندگی (75) – که هر دو با هدف شناسایی پیشبینیکنندههای کاهش و حفظ موفقیتآمیز وزن و گنجاندن اطلاعات مربوط به عوامل ژنتیکی، روانی-اجتماعی، رفتاری، بیولوژیکی و محیطی در پروفایلهای پیشبینیکننده برای امکانپذیر کردن مداخلات دقیقتر و در نهایت مؤثرتر کاهش وزن انجام میشوند.
NCI از طریق فعالیتهای متنوعی از جمله ابتکارات مشارکتی بزرگ، منابع وب و دادهها، مطالعات اپیدمیولوژیک و علوم پایه، و منابع انتشار و اجرا، از تحقیقات در مورد چاقی و خطر سرطان حمایت میکند. به عنوان مثال، طرح تحقیقات بین رشتهای در مورد انرژی و سرطان (TREC) از کارگاههای آموزشی مداوم برای محققان پسادکتری و تازه کار حمایت میکند تا توانایی تولید تحقیقات بین رشتهای نوآورانه و تأثیرگذار در زمینه انرژی و سرطان و مراقبتهای بالینی را افزایش دهد. برنامه اختلال تنظیم متابولیک و خطر سرطان NCI از تحقیقات در مورد مکانیسمهای بیولوژیکی زمینهساز توسعه سرطانهای مرتبط با چاقی حمایت میکند و نشانگرهای بالقوه را برای افزایش پیشبینی خطر سرطان، بهبود غربالگری برای افراد پرخطر و شناسایی اهداف برای مداخلات پیشگیرانه و درمانی سرطانهای مرتبط با چاقی شناسایی میکند.
کنسرسیوم مداخلات ورزشی و تغذیهای برای بهبود پیامدهای مرتبط با درمان سرطان (ENICTO) در بازماندگان سرطان، یک برنامه تحقیقاتی مشترک با بودجه NCI است که هدف آن بهبود آینده مراقبت از سرطان از طریق رویکردهای ورزشی و غذایی است.
منابع منتخب
- Garvey WT, Mechanick JI. Proposal for a scientifically correct and medically actionable disease classification system (ICD) for obesity. Obesity (Silver Spring) 2020; 28(3):484–492. [PubMed Abstract]
- Berrington de Gonzalez A, Hartge P, Cerhan JR, et al. Body-mass index and mortality among 1.46 million white adults. New England Journal of Medicine 2010; 363(23):2211–2119. [PubMed Abstract]
- Kitahara CM, Flint AJ, Berrington de Gonzalez A, et al. Association between class III obesity (BMI of 40–59 kg/m2) and mortality: A pooled analysis of 20 prospective studies. PLoS Medicine 2014; 11(7):e1001673. [PubMed Abstract]
- Adams KF, Schatzkin A, Harris TB, et al. Overweight, obesity, and mortality in a large prospective cohort of persons 50 to 71 years old. New England Journal of Medicine 2006; 355(8):763–778. [PubMed Abstract]
- Cohen SS, Park Y, Signorello LB, et al. A pooled analysis of body mass index and mortality among African Americans. PLoS One 2014; 9(11):e111980. [PubMed Abstract]
- Sweatt K, Garvey WT, Martins C. Strengths and limitations of BMI in the diagnosis of obesity: What is the path forward? Current Obesity Reports 2024; 13(3):584–595. doi: 10.1007/s13679-024-00580-1
- Fryar CD, Carroll MD, Afful J. Prevalence of overweight, obesity, and severe obesity among children and adolescents aged 2–19 years: United States, 1963–1965 through 2017–2018. NCHS Health E-Stats. 2020.
- Zhang X, Ma N, Lin Q, et al. Body roundness index and all-cause mortality among US adults. JAMA Network Open 2024; 7(6):e2415051. [PubMed Abstract]
- Centers for Disease Control and Prevention. National Center for Chronic Disease Prevention and Health Promotion, Division of Nutrition, Physical Activity, and Obesity: Data, Trend and Maps [online]. [accessed Dec 26, 2024]. URL: https://www.cdc.gov/nccdphp/dnpao/data-trends-maps/index.html
- GBD 2021 US Obesity Forecasting Collaborators. National-level and state-level prevalence of overweight and obesity among children, adolescents, and adults in the USA, 1990–2021, and forecasts up to 2050. Lancet 2024; 404(10469):2278–2298. [PubMed Abstract]
- Setiawan VW, Yang HP, Pike MC, et al. Type I and II endometrial cancers: Have they different risk factors? Journal of Clinical Oncology 2013; 31(20):2607–2618. [PubMed Abstract]
- Dougan MM, Hankinson SE, Vivo ID, et al. Prospective study of body size throughout the life-course and the incidence of endometrial cancer among premenopausal and postmenopausal women. International Journal of Cancer 2015; 137(3):625–637. [PubMed Abstract]
- Hoyo C, Cook MB, Kamangar F, et al. Body mass index in relation to oesophageal and oesophagogastric junction adenocarcinomas: A pooled analysis from the International BEACON Consortium. International Journal of Epidemiology 2012; 41(6):1706–1718. [PubMed Abstract]
- Chen Y, Liu L, Wang X, et al. Body mass index and risk of gastric cancer: A meta-analysis of a population with more than ten million from 24 prospective studies. Cancer Epidemiology, Biomarkers & Prevention 2013; 22(8):1395–1408. [PubMed Abstract]
- Chen Y, Wang X, Wang J, Yan Z, Luo J. Excess body weight and the risk of primary liver cancer: An updated meta-analysis of prospective studies. European Journal of Cancer 2012; 48(14):2137–2145. [PubMed Abstract]
- Campbell PT, Newton CC, Freedman ND, et al. Body mass index, waist circumference, diabetes, and risk of liver cancer for U.S. adults. Cancer Research 2016; 76(20):6076–6083. [PubMed Abstract]
- Wang F, Xu Y. Body mass index and risk of renal cell cancer: A dose-response meta-analysis of published cohort studies. International Journal of Cancer 2014; 135(7):1673–1686. [PubMed Abstract]
- Sanfilippo KM, McTigue KM, Fidler CJ, et al. Hypertension and obesity and the risk of kidney cancer in 2 large cohorts of US men and women. Hypertension 2014; 63(5):934–941. [PubMed Abstract]
- Wallin A, Larsson SC. Body mass index and risk of multiple myeloma: A meta-analysis of prospective studies. European Journal of Cancer 2011; 47(11):1606–1615. [PubMed Abstract]
- Niedermaier T, Behrens G, Schmid D, et al. Body mass index, physical activity, and risk of adult meningioma and glioma: A meta-analysis. Neurology 2015; 85(15):1342–1350. [PubMed Abstract]
- Genkinger JM, Spiegelman D, Anderson KE, et al. A pooled analysis of 14 cohort studies of anthropometric factors and pancreatic cancer risk. International Journal of Cancer 2011; 129(7):1708–1717. [PubMed Abstract]
- Ma Y, Yang Y, Wang F, et al. Obesity and risk of colorectal cancer: A systematic review of prospective studies. PLoS One 2013; 8(1):e53916. [PubMed Abstract]
- World Cancer Research Fund International/American Institute for Cancer Research. Continuous Update Project Expert Report 2018. Diet, nutrition, physical activity and gallbladder cancer. Available at https://www.wcrf.org/wp-content/uploads/2021/02/gallbladder-cancer-report.pdf.
- Li L, Gan Y, Li W, Wu C, Lu Z. Overweight, obesity and the risk of gallbladder and extrahepatic bile duct cancers: A meta-analysis of observational studies. Obesity (Silver Spring) 2016; 24(8):1786–1802. [PubMed Abstract]
- Renehan AG, Tyson M, Egger M, Heller RF, Zwahlen M. Body-mass index and incidence of cancer: A systematic review and meta-analysis of prospective observational studies. Lancet 2008; 371(9612):569–578. [PubMed Abstract]
- Munsell MF, Sprague BL, Berry DA, Chisholm G, Trentham-Dietz A. Body mass index and breast cancer risk according to postmenopausal estrogen-progestin use and hormone receptor status. Epidemiologic Reviews 2014; 36:114–136. [PubMed Abstract]
- Collaborative Group on Epidemiological Studies of Ovarian Cancer. Ovarian cancer and body size: Individual participant meta-analysis including 25,157 women with ovarian cancer from 47 epidemiological studies. PLoS Medicine 2012; 9(4):e1001200. [PubMed Abstract]
- Wentzensen N, Poole EM, Trabert B, et al. Ovarian cancer risk factors by histologic subtype: An analysis from the ovarian cancer cohort consortium. Journal of Clinical Oncology 2016; 34(24):2888–2898. [PubMed Abstract]
- Kitahara CM, Pfeiffer RM, Sosa JA, Shiels MS. Impact of overweight and obesity on US papillary thyroid cancer incidence trends (1995–2015). Journal of the National Cancer Institute 2020; 112(8):810–817. [PubMed Abstract]
- Recalde M, Pistillo A, Davila-Batista V, et al. Longitudinal body mass index and cancer risk: A cohort study of 2.6 million Catalan adults. Nature Communications 2023; 14(1):3816. [PubMed Abstract]
- Bodelon C, Sung H, Mitchell EL, et al. Excess body weight and the risk of second primary cancers among cancer survivors. JAMA Network Open 2024; 7(9):e2433132. [PubMed Abstract]
- Sung H, Hyun N, Leach CR, Yabroff KR, Jemal A. Association of first primary cancer with risk of subsequent primary cancer among survivors of adult-onset cancers in the United States. JAMA 2020; 324(24):2521–2535. [PubMed Abstract]
- Gibson TM, Park Y, Robien K, et al. Body mass index and risk of second obesity-associated cancers after colorectal cancer: A pooled analysis of prospective cohort studies. Journal of Clinical Oncology 2014; 32(35):4004–4011. [PubMed Abstract]
- Feigelson HS, Bodelon C, Powers JD, et al. Body mass index and risk of second cancer among women with breast cancer. Journal of the National Cancer Institute 2021; 113(9):1156–1160. [PubMed Abstract]
- Friedenreich CM, Ryder-Burbidge C, McNeil J. Physical activity, obesity and sedentary behavior in cancer etiology: Epidemiologic evidence and biologic mechanisms. Molecular Oncology 2021; 15(3):790–800. [PubMed Abstract]
- Liu XZ, Pedersen L, Halberg N. Cellular mechanisms linking cancers to obesity. Cell Stress 2021; 5(5):55–72. [PubMed Abstract]
- Knuppel A, Fensom GK, Watts EL, et al. Circulating insulin-like growth factor-I concentrations and risk of 30 cancers: Prospective analyses in UK Biobank. Cancer Research 2020; 80(18):4014–4021 [PubMed Abstract]
- Leitner BP, Siebel S, Akingbesote ND, Zhang X, Perry RJ. Insulin and cancer: A tangled web. The Biochemical Journal 2022; 479(5):583–607. [PubMed Abstract]
- Greten FR, Grivennikov SI. Inflammation and cancer: Triggers, mechanisms, and consequences. Immunity 2019; 51(1):27–41. [PubMed Abstract]
- Kim JW, Kim JH, Lee YJ. The role of adipokines in tumor progression and its association with obesity. Biomedicines 2024; 12(1):97. [PubMed Abstract]
- Behrooz AB, Cordani M, Fiore A, et al. The obesity-autophagy-cancer axis: Mechanistic insights and therapeutic perspectives. Seminars in Cancer Biology 2024; 99:24–44. [PubMed Abstract]
- Seo BR, Bhardwaj P, Choi S. Obesity-dependent changes in interstitial ECM mechanics promote breast tumorigenesis. Science Translational Medicine 2015; 7(301):301ra130. [PubMed Abstract]
- Derakhshan MH, Robertson EV, Fletcher J, et al. Mechanism of association between BMI and dysfunction of the gastro-oesophageal barrier in patients with normal endoscopy. Gut 2012; 61(3):337–343. [PubMed Abstract]
- Clarke MA, Fetterman B, Cheung LC, et al. Epidemiologic evidence that excess body weight increases risk of cervical cancer by decreased detection of precancer. Journal of Clinical Oncology 2018; 36(12):1184–1191. [PubMed Abstract]
- Islami F, Marlow EC, Thomson B, et al. Proportion and number of cancer cases and deaths attributable to potentially modifiable risk factors in the United States, 2019. CA: A Cancer Journal for Clinicians 2024; 74(5):405–432. [PubMed Abstract]
- Chen J, Dalerba P, Terry MB, Yang W. Global obesity epidemic and rising incidence of early-onset cancers. Journal of Global Health 2024; 14:04205. [PubMed Abstract]
- Sudan SK, Sharma A, Vikramdeo KS, et al. Obesity and early-onset breast cancer and specific molecular subtype diagnosis in Black and White women: NIMHD Social Epigenomics Program. JAMA Network Open 2024; 7(7):e2421846. [PubMed Abstract]
- Micaily I, Hackbart H, Butryn M, Abu-Khalaf MM. Obesity in early onset breast cancer in African American patients. The Breast Journal 2021; 27(7):603–607. [PubMed Abstract]
- Sauter ER, Butera G, Agurs-Collins T. Long-term randomized controlled trials of diet intervention reports and their impact on cancer: A systematic review. Cancers (Basel) 2024; 16(19):3296. [PubMed Abstract]
- Luo J, Hendryx M, Manson JE, et al. Intentional weight loss and obesity-related cancer risk. JNCI Cancer Spectrum 2019; 3(4):pkz054. [PubMed Abstract]
- Chlebowski RT, Luo J, Anderson GL, et al. Weight loss and breast cancer incidence in postmenopausal women. Cancer 2019; 125(2):205–212. [PubMed Abstract]
- Teras LR, Patel AV, Wang M, et al. Sustained weight loss and risk of breast cancer in women 50 years and older: A pooled analysis of prospective data. Journal of the National Cancer Institute 2020; 112(9):929–937. [PubMed Abstract]
- Madar LO, Goldberg N, Netz U, et al. Association between metabolic and bariatric surgery and malignancy: A systematic review, meta-analysis, trends, and conclusions. Surgery for Obesity and Related Diseases: Official Journal of the American Society for Bariatric Surgery 2024:S1550–7289(24)00866-9. [PubMed Abstract]
- Tee MC, Cao Y, Warnock GL, Hu FB, Chavarro JE. Effect of bariatric surgery on oncologic outcomes: A systematic review and meta-analysis. Surgical Endoscopy 2013; 27(12):4449–4456. [PubMed Abstract]
- Kristensson FM, Andersson-Assarsson JC, Peltonen M, et al. Breast cancer risk after bariatric surgery and influence of insulin levels: A nonrandomized controlled trial. JAMA Surgery 2024; 159(8):856–863. [PubMed Abstract]
- Mackenzie H, Markar SR, Askari A, et al. Obesity surgery and risk of cancer. British Journal of Surgery 2018; 105(12):1650–1657. [PubMed Abstract]
- Schauer DP, Feigelson HS, Koebnick C, et al. Bariatric surgery and the risk of cancer in a large multisite cohort. Annals of Surgery 2019; 269(1):95–101. [PubMed Abstract]
- Aminian A, Wilson R, Al-Kurd A, et al. Association of bariatric surgery with cancer Risk and mortality in adults with obesity. JAMA 2022; 327(24):2423–2433. [PubMed Abstract]
- Lazzati A, Poghosyan T, Touati M, Collet D, Gronnier C. Risk of esophageal and gastric cancer after bariatric surgery. JAMA Surgery 2023; 158(3):264–271. [PubMed Abstract]
- Wang L, Xu R, Kaelber DC, Berger NA. Glucagon-like peptide 1 receptor agonists and 13 obesity-associated cancers in patients with type 2 diabetes. JAMA Network Open 2024; 7(7):e2421305. [PubMed Abstract]
- Figlioli G, Piovani D, Peppas S, et al. Glucagon-like peptide-1 receptor agonists and risk of gastrointestinal cancers: A systematic review and meta-analysis of randomized controlled trials. Pharmacological Research 2024; 208:107401. [PubMed Abstract]
- Calle EE, Rodriguez C, Walker-Thurmond K, Thun MJ. Overweight, obesity, and mortality from cancer in a prospectively studied cohort of U.S. adults. New England Journal of Medicine 2003; 348(17):1625–1638. [PubMed Abstract]
- Schmitz KH, Neuhouser ML, Agurs-Collins T, et al. Impact of obesity on cancer survivorship and the potential relevance of race and ethnicity. Journal of the National Cancer Institute 2013; 105(18):1344–1354. [PubMed Abstract]
- Paskett ED, Dean JA, Oliveri JM, Harrop JP. Cancer-related lymphedema risk factors, diagnosis, treatment, and impact: A review. Journal of Clinical Oncology 2012; 30(30):3726–3733. [PubMed Abstract]
- Gacci M, Sebastianelli A, Salvi M, et al. Role of abdominal obesity for functional outcomes and complications in men treated with radical prostatectomy for prostate cancer: Results of the Multicenter Italian Report on Radical Prostatectomy (MIRROR) study. Scandinavian Journal of Urology 2014; 48(2):138–145. [PubMed Abstract]
- Meyerhardt JA, Tepper JE, Niedzwiecki D, et al. Impact of body mass index on outcomes and treatment-related toxicity in patients with stage II and III rectal cancer: Findings from Intergroup Trial 0114. Journal of Clinical Oncology 2004; 22(4):648–657. [PubMed Abstract]
- Teras LR, Kitahara CM, Birmann BM, et al. Body size and multiple myeloma mortality: A pooled analysis of 20 prospective studies. British Journal of Haematology 2014; 166(5):667–676. [PubMed Abstract]
- Goodwin PJ, Segal RJ, Vallis M, et al. Randomized trial of a telephone-based weight loss intervention in postmenopausal women with breast cancer receiving letrozole: The LISA trial. Journal of Clinical Oncology 2014; 32(21):2231–2239. [PubMed Abstract]
- Harrigan M, Cartmel B, Loftfield E, et al. Randomized trial comparing telephone versus in-person weight loss counseling on body composition and circulating biomarkers in women treated for breast cancer: The Lifestyle, Exercise, and Nutrition (LEAN) Study. Journal of Clinical Oncology 2016; 34(7):669–676. [PubMed Abstract]
- Goodwin PJ. Obesity and breast cancer outcomes: How much evidence is needed to change practice? Journal of Clinical Oncology 2016; 34(7):646–648. Epub 2015 Dec 28. doi: 10.1200/JCO.2015.64.7503.
- Delahanty LM, Wadden TA, Goodwin PJ, et al. The Breast Cancer Weight Loss trial (Alliance A011401): A description and evidence for the lifestyle intervention. Obesity (Silver Spring) 2022; 30(1):28-38. [PubMed Abstract]
- Bandera EV, Alfano CM, Qin B, et al. Harnessing nutrition and physical activity for breast cancer prevention and control to reduce racial/ethnic cancer health disparities. American Society of Clinical Oncology educational book 2021; 41:1–17. [PubMed Abstract]
- WHO Expert Consultation. Appropriate body-mass index for Asian populations and its implications for policy and intervention strategies. Lancet 2004; 363(9403):157–163. [PubMed Abstract]
- MacLean PS, Rothman AJ, Nicastro HL, et al. The Accumulating Data to Optimally Predict Obesity Treatment (ADOPT) core measures project: Rationale and approach. Obesity (Silver Spring) 2018; 26 Suppl 2(Suppl 2):S6–S15. [PubMed Abstract]
- Bray MS, Loos RJ, McCaffery JM, et al. NIH working group report-using genomic information to guide weight management: From universal to precision treatment. Obesity (Silver Spring) 2016; 24(1):14–22. [PubMed Abstract]
تهیه و تنظیم: سید طه نوربخش
نظارت و تأیید: فائزه محمدهاشم-متخصص ژنتیک