آنچه در این مطلب خواهید خواند
- پولیپهای کولورکتال به عنوان پیشساز سرطان کولورکتال (CRC)
- سابقه خانوادگی به عنوان یک عامل خطر برای سرطان کولورکتال
- وراثت استعداد ابتلا به سرطان کولورکتال (CRC)
- شناسایی افراد در معرض خطر ژنتیکی بالای سرطان کولورکتال
- دشواریهای شناسایی سابقه خانوادگی خطر ابتلا به سرطان کولورکتال
- رویدادهای مولکولی مرتبط با سرطانزایی روده بزرگ
- نتیجهگیری
سرطان کولورکتال (CRC) سومین سرطان شایع تشخیص داده شده در مردان و زنان است.
موارد جدید و مرگ و میر ناشی از سرطان کولورکتال در سال 2024 در ایالات متحده تخمین زده شده است [1]:
- موارد جدید: ۱۵۲,۸۱۰.
- مرگ و میر: ۵۳۰۱۰ نفر.
در ایران، سالانه حدود ۱٬۱۵۰ نفر مرگ بر اثر سرطان کولورکتال رخ میدهد.
حدود 75٪ از بیماران مبتلا به سرطان روده بزرگ (CRC) از نوع اسپورادیک دارند و هیچ شواهد آشکاری مبنی بر ارثی بودن این اختلال وجود ندارد. 10 تا 30 درصد باقیمانده از بیماران سابقه خانوادگی سرطان روده بزرگ (CRC) دارند که نشان دهنده سهم ارثی، مواجهههای مشترک یا عوامل خطر مشترک در بین اعضای خانواده یا ترکیبی از هر دو است.[2] واریانت
های بیماریزا در ژنهای با نفوذ بالا به عنوان علت خطر ارثی سرطان در برخی از خانوادههای مستعد سرطان روده بزرگ شناسایی شدهاند. تخمین زده میشود که این موارد تنها 5 تا 6 درصد از موارد کلی سرطان روده بزرگ را تشکیل میدهند.[3، 4] علاوه بر این، واریانتهای بیماریزا در ژنهای با نفوذ پایینتر ممکن است در خطر ابتلا به سرطان روده بزرگ خانوادگی نقش داشته باشند. در چنین مواردی، تعاملات ژن-ژن و ژن-محیط ممکن است در ایجاد سرطان روده بزرگ نقش داشته باشند.
پولیپهای کولورکتال به عنوان پیشساز سرطان کولورکتال (CRC)
تومورهای کولورکتال طیف وسیعی از نئوپلاسمها، از تومورهای خوشخیم گرفته تا سرطانهای مهاجم، را شامل میشوند و عمدتاً تومورهای مشتق از اپیتلیال (یعنی آدنومها یا آدنوکارسینوماها) هستند.
تبدیل هر پولیپی به سرطان از طریق توالی آدنوم-کارسینوم انجام میشود. پولیپهایی که به طور سنتی غیر نئوپلاستیک در نظر گرفته میشوند شامل انواع هایپرپلاستیک، جوان، هامارتوماتوز، التهابی و لنفوئیدی هستند. با این حال، در شرایط خاص، پولیپهای هامارتوماتوز و جوان میتوانند به سرطان تبدیل شوند.
با این حال، تحقیقات نشان میدهد که خطر قابل توجهی از ابتلا به سرطان روده بزرگ در افراد مبتلا به سندرم پولیپوز نوجوانان و سندرم پوتز-جگرز وجود دارد، اگرچه پولیپهای غیرآدنوماتوز مرتبط با این سندرمها از نظر تاریخی به عنوان غیر نئوپلاستیک در نظر گرفته شدهاند. [5-7]
مطالعات اپیدمیولوژیک نشان دادهاند که سابقه شخصی آدنومهای روده بزرگ، فرد را در معرض خطر بیشتری برای ابتلا به سرطان روده بزرگ قرار میدهد.[8]
دو تفسیر مکمل از این مشاهده به شرح زیر است:
- آدنوم ممکن است نشاندهندهی تمایل ذاتی یا اکتسابی روده بزرگ برای تشکیل تومور باشد.
- آدنومها ضایعه پیشساز اولیه سرطان روده بزرگ هستند.
بیش از 95٪ از سرطانهای کولورکتال (CRC) کارسینوم هستند و حدود 95٪ از آنها آدنوکارسینوم میباشند. به خوبی شناخته شده است که پولیپهای آدنوماتوز تومورهای خوشخیمی هستند که ممکن است دچار تغییر بدخیم شوند. آنها به سه نوع بافتشناسی طبقهبندی شدهاند که پتانسیل بدخیمی آنها رو به افزایش است: لولهای، لولهای-پرزدار و پرزدار. آدنوکارسینومها معمولاً بر اساس مشاهدات مهم زیر، از آدنومها ناشی میشوند [9-13]:
- بافت خوشخیم و بدخیم در تومورهای کولورکتال وجود دارد.[14]
- وقتی بیماران مبتلا به آدنوم به مدت 20 سال تحت نظر قرار گرفتند، خطر ابتلا به سرطان در محل آدنوم 25 درصد بود، نرخی بسیار بالاتر از آنچه در جمعیت عادی انتظار میرود.[15]
سه ویژگی آدنومهای زیر با پتانسیل تبدیل شدن به سرطان همبستگی بالایی دارند:[14]
- سایز بزرگتر.
- آسیب شناسی پرزهای بدن.
- درجه دیسپلازی درون آدنوم.
علاوه بر این، برداشتن پولیپهای آدنوماتوز با کاهش بروز سرطان کولورکتال (CRC) مرتبط است.[16، 17] در حالی که اکثر آدنومها پولیپوئیدی هستند، ضایعات مسطح و فرورفته ممکن است شایعتر از آنچه قبلاً تصور میشد، باشند. ضایعات بزرگ، مسطح و فرورفته ممکن است به احتمال زیاد به شدت دیسپلاستیک باشند، اگرچه این موضوع هنوز به وضوح اثبات نشده است.[18، 19] ممکن است برای شناسایی، بیوپسی و برداشتن چنین ضایعاتی به تکنیکهای تخصصی نیاز باشد.[20]
سابقه خانوادگی به عنوان یک عامل خطر برای سرطان کولورکتال
برخی از اولین مطالعات در مورد سابقه خانوادگی سرطان کولورکتال (CRC) مربوط به خانوادههای یوتا بود که درصد بالاتری از مرگ و میر ناشی از سرطان کولورکتال (3.9٪) را در بین بستگان درجه یک (FDR) بیمارانی که بر اثر سرطان کولورکتال فوت کرده بودند، نسبت به گروه کنترل همسان از نظر جنس و سن (1.2٪) گزارش کردند.[21] این تفاوت از آن زمان در مطالعات متعددی تکرار شده است که به طور مداوم نشان دادهاند که بستگان درجه یک موارد مبتلا، خود در معرض خطر دو تا سه برابر بیشتر ابتلا به سرطان کولورکتال هستند. علیرغم طرحهای مختلف مطالعه (مورد-شاهدی، کوهورت)، چارچوبهای نمونهگیری، اندازه نمونه، روشهای تأیید دادهها، روشهای تحلیلی و کشورهایی که مطالعات از آنجا سرچشمه گرفتهاند، میزان خطر ثابت است.[22-27]
یک بررسی سیستماتیک و متاآنالیز از خطر ابتلا به سرطان روده بزرگ خانوادگی گزارش شده است.[28] از 24 مطالعهای که در این تجزیه و تحلیل گنجانده شدهاند، همه به جز یکی، افزایش خطر ابتلا به سرطان روده بزرگ را در صورت وجود یک فرد مبتلا به سرطان خانواده گزارش کردهاند. خطر نسبی (RR) برای سرطان روده بزرگ در مطالعه تجمیعی 2.25 (فاصله اطمینان 95% [CI]، 2.00-2.53) در صورت وجود یک فرد مبتلا به سرطان خانواده بود. در 8 مورد از 11 مطالعه، اگر سرطان شاخص در روده بزرگ ایجاد شود، خطر کمی بیشتر از زمانی بود که در رکتوم ایجاد شود. تجزیه و تحلیل تجمیعی، RR را در بستگان بیماران مبتلا به سرطان روده بزرگ و رکتوم به ترتیب 2.42 (فاصله اطمینان 95%، 2.20-2.65) و 1.89 (فاصله اطمینان 95%، 1.62-2.21) نشان داد. این تجزیه و تحلیل تفاوتی در RR برای سرطان روده بزرگ بر اساس محل تومور (سمت راست در مقابل سمت چپ) نشان نداد.
تعداد اعضای خانواده مبتلا و سن در زمان تشخیص سرطان با خطر ابتلا به سرطان روده بزرگ (CRC) همبستگی داشت. در مطالعاتی که بیش از یک FDR مبتلا به سرطان روده بزرگ را گزارش کردند، RR برابر با 3.76 (95% CI، 2.56-5.51) بود. بالاترین RR زمانی مشاهده شد که مورد شاخص در افراد زیر 45 سال تشخیص داده شد (RR، 3.87؛ 95% CI، 2.40-6.22) در مقایسه با اعضای خانواده موارد شاخص تشخیص داده شده در سنین 45 تا 59 سال (RR، 2.25؛ 95% CI، 1.85-2.72) و اعضای خانواده موارد شاخص تشخیص داده شده در سن 60 سال یا بالاتر (RR، 1.82؛ 95% CI، 1.47-2.25). در این متاآنالیز، خطر خانوادگی ابتلا به سرطان روده بزرگ مرتبط با آدنوم در یک FDR مورد تجزیه و تحلیل قرار گرفت. تجزیه و تحلیل تجمیعی، RR 1.99 (95% CI، 1.55-2.55) را برای سرطان کولورکتال در افرادی که خویشاوند نزدیکشان آدنوم داشت، نشان داد.[28] این یافته تأیید شده است.[29] مطالعات دیگر گزارش دادهاند که سن در زمان تشخیص آدنوم بر خطر سرطان کولورکتال تأثیر میگذارد، به طوری که سن پایینتر در زمان تشخیص آدنوم با RR بالاتر مرتبط است.[30،31] مانند هر متاآنالیز دیگری، ممکن است سوگیریهای بالقوهای وجود داشته باشد که ممکن است بر نتایج تجزیه و تحلیل تأثیر بگذارد، از جمله بررسی ناقص و غیرتصادفی مطالعات شامل شده؛ سوگیری انتشار؛ و ناهمگونی بین مطالعات مربوط به طراحی، جمعیت هدف و انتخاب گروه کنترل. این مطالعه تأیید میکند که ارتباط معناداری بین خطر سرطان کولورکتال خانوادگی، سن در زمان تشخیص سرطان کولورکتال و آدنوم، و تعدد اعضای خانواده مبتلا وجود دارد.جدول 1. خطر نسبی و مطلق تخمینی ابتلا به سرطان کولورکتال (CRC)
| سابقه خانوادگی | خطر نسبی سرطان کولورکتال [28] | خطر مطلق (%) سرطان کولورکتال تا سن ۷۹ سالگی |
|---|---|---|
| سابقه خانوادگی ندارد | ۱ | ۴ الف |
| یک FDR با CRC | ۲.۳ (۹۵٪ فاصله اطمینان، ۲.۰-۲.۵) | ۹ ب |
| بیش از یک FDR با CRC | ۴.۳ (۹۵٪ فاصله اطمینان، ۳.۰-۶.۱) | ۱۶ ب |
| یکی از بستگان درجه یک مبتلا، قبل از ۴۵ سالگی به سرطان روده بزرگ مبتلا شده باشد | ۳.۹ (۹۵٪ فاصله اطمینان، ۲.۴-۶.۲) | ۱۵ ب |
| یک FDR با آدنوم کولورکتال | ۲.۰ (۹۵٪ فاصله اطمینان، ۱.۶-۲.۶) | ۸ ب |
| CI = فاصله اطمینان؛ FDR = خویشاوند درجه یک. | ||
| الف) دادههایی از پایگاه داده برنامه نظارت، اپیدمیولوژی و نتایج نهایی. | ||
| ب) خطرات مطلق ابتلا به سرطان کولورکتال (CRC) برای افراد دارای بستگان مبتلا با استفاده از خطرات نسبی ابتلا به سرطان کولورکتال [28] و خطر مطلق ابتلا به سرطان کولورکتال تا سن 79 سالگی محاسبه شد. | ||
وقتی سابقه خانوادگی شامل دو یا چند خویشاوند مبتلا به سرطان کولورکتال (CRC) باشد، احتمال ابتلا به یک سندرم ژنتیکی به طور قابل توجهی افزایش مییابد. اولین قدم در این ارزیابی، بررسی دقیق سابقه خانوادگی برای تعیین تعداد خویشاوندان مبتلا، نسبت آنها با یکدیگر، سن تشخیص سرطان کولورکتال، وجود چندین سرطان کولورکتال اولیه و وجود هرگونه سرطان دیگر (به عنوان مثال، آندومتر) سازگار با سندرم ارثی سرطان کولورکتال است. اکنون مدلهای کامپیوتری برای تخمین احتمال ابتلا به سرطان کولورکتال در دسترس هستند [32]. این مدلها میتوانند در ارائه مشاوره ژنتیکی به افراد با خطر متوسط و بالای ابتلا به سرطان مفید باشند. علاوه بر این، حداقل سه مدل معتبر نیز برای پیشبینی احتمال حمل یک واریانت بیماریزا در ژن ترمیم عدم تطابق (MMR) در دسترس است [33-53].
وراثت استعداد ابتلا به سرطان کولورکتال (CRC)
چندین ژن مرتبط با خطر ابتلا به سرطان روده بزرگ (CRC) شناسایی شدهاند؛ تقریباً تمام واریانتهای بیماریزایی که باعث ایجاد استعداد ابتلا به سرطان روده بزرگ میشوند، به صورت اتوزومال غالب به ارث میرسند [37]. یک نمونه از وراثت اتوزومال مغلوب، پولیپوز مرتبط با MUTYH (MAP)، شناسایی شده است. بنابراین، ویژگیهای خانوادگی که نشاندهنده وراثت اتوزومال غالب استعداد ابتلا به سرطان هستند، شاخصهای مهمی از خطر بالا و احتمال وجود یک واریانتبیماریزای مستعد کننده سرطان هستند. این موارد شامل موارد زیر است:
- انتقال عمودی استعداد ابتلا به سرطان در شرایط اتوزومال غالب. (انتقال عمودی به وجود یک استعداد ژنتیکی در نسلهای متوالی اشاره دارد.)
- خطر ارثی ۵۰٪ برای فرزندان پسر و دختر. وقتی والدینی حامل استعداد ژنتیکی اتوزومال غالب باشند، هر فرزند ۵۰٪ احتمال دارد که این استعداد را به ارث ببرد. این خطر برای فرزندان پسر و دختر یکسان است.
- سایر ویژگیهای بالینی نیز نشاندهنده وجود سندرم ارثی CRC هستند:
- سرطانها در افرادی که زمینه ارثی دارند، معمولاً در سنین پایینتری نسبت به موارد اسپورادیک رخ میدهند.[38]
- استعداد ابتلا به سرطان کولورکتال (CRC) ممکن است شامل استعداد ابتلا به سایر سرطانها، مانند سرطان آندومتر، نیز باشد.
- علاوه بر این، ممکن است دو یا چند سرطان اولیه در یک فرد رخ دهد. این موارد میتوانند چندین سرطان اولیه از یک نوع (مثلاً دو سرطان کولورکتال اولیه جداگانه) یا سرطان اولیه از انواع مختلف (مثلاً سرطان روده بزرگ و آندومتر در یک فرد) باشند.
- وجود ویژگیهای خارج رودهای غیرنئوپلاستیک ممکن است نشاندهنده یک سندرم استعداد ارثی به سرطان روده بزرگ باشد (مثلاً هیپرتروفی مادرزادی اپیتلیوم رنگدانهای شبکیه و تومورهای دسموئید در پولیپوز آدنوماتوز خانوادگی [FAP]).
- یک تومور غیرمعمول (مثلاً کارسینوم قشر فوق کلیوی، آدنوم یا کارسینوم سباسه و تریکیلموما) میتواند به عنوان سرنخی برای وجود یک سندرم سرطان ارثی باشد.
- وجود پولیپهای متعدد ممکن است نشاندهنده سندرم استعداد ارثی سرطان روده بزرگ باشد. از آنجایی که حساسیت به الیگوپولیپوز (به تعداد کم ۱۰ تا ۱۵ پولیپ) آشکار شده است، پزشکان و به ویژه متخصصان آندوسکوپی دستگاه گوارش، ممکن است آزمایش چند ژنی (پانل) از فهرست رو به گسترش ژنهای مرتبط با سرطان کولورکتال را در نظر بگیرند. (برای اطلاعات بیشتر به جدول ۲ ، ژنهای مرتبط با حساسیت بالای سرطان کولورکتال مراجعه کنید.) از آنجایی که الیگوپولیپوز همچنین شامل آسیبشناسی متنوعی (از جمله هامارتومها، پولیپهای دندانهدار بیپایه و آدنومهای دندانهدار بیپایه) است، توجه دقیق به تعداد پولیپها و بافتشناسی پولیپها به تعیین اینکه آیا آزمایش ژنتیکی و/یا ارزیابی بالینی بیشتر مناسب است یا خیر، کمک میکند.
دو علت شایع سرطان کولورکتال ارثی عبارتند از FAP (شامل AFAP)، به دلیل واریانتهای بیماریزای ژرملاین در ژنAPC ، [39-46] و سندرم لینچ (که قبلاً سرطان کولورکتال غیرپولیپی ارثی [HNPCC] نامیده میشد) که توسط واریانتهای بیماریزای ژرملاین در ژنهای DNA MMR ایجاد میشود.[ 47-50] ( شکل 2 یک خانواده کلاسیک مبتلا به سندرم لینچ را نشان میدهد که برخی از شاخصهای سرطان کولورکتال ارثی را که در بالا توضیح داده شده است، برجسته میکند.) بسیاری از خانوادههای دیگر تجمع سرطان کولورکتال و/یا آدنومها را نشان میدهند، اما هیچ ارتباط آشکاری با یک سندرم ارثی قابل شناسایی ندارند و در مجموع به عنوان سرطان کولورکتال خانوادگی شناخته میشوند [37].
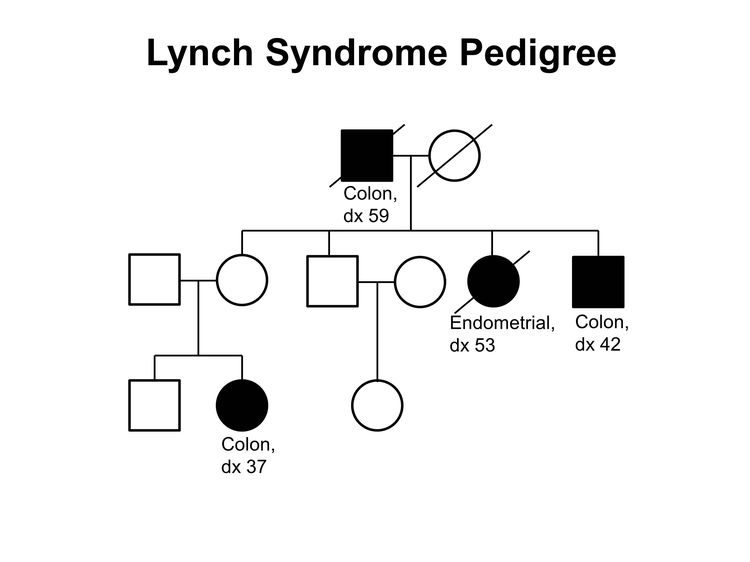
شناسایی افراد در معرض خطر ژنتیکی بالای سرطان کولورکتال
دستورالعملهای شبکه جامع ملی سرطان (NCCN) سالانه بهروزرسانی میشوند تا به شناسایی بیمارانی که برای ارجاع به خدمات مشاوره ژنتیک سرطان مناسب هستند، کمک کنند. علاوه بر این، NCCN توصیههای نظارت بر سرطان را برای سندرمهای سرطان ارثی نیز ارائه میدهد. کالج آمریکایی ژنتیک و ژنومیک پزشکی و انجمن ملی مشاوران ژنتیک مجموعهای جامع از معیارهای سابقه شخصی/خانوادگی را برای کمک به شناسایی افراد در معرض خطر برای ارجاع به مشاورههای خطر ژنتیک سرطان منتشر کردهاند.[51] این دستورالعملهای عملی، انواع تومور، سایر ویژگیهای خاص تومور و معیارهای مرتبطی را که باعث ارجاع ژنتیکی میشوند، در نظر میگیرند. نویسندگان اظهار میکنند که این دستورالعملهای ACMG/NSGC برای به حداکثر رساندن ارجاع افراد در معرض خطر مناسب به خدمات مشاوره ژنتیک سرطان در نظر گرفته شدهاند، اما به معنای ارائه آزمایش ژنتیکی یا توصیههای درمانی نیستند. علاوه بر این، نویسندگان به منابع دیگری اشاره میکنند که در مورد معیارهای آزمایش ژنتیکی بهروز شده/در حال تکامل برای سندرمهای سرطان ارثی (به عنوان مثال، NCCN) بحث میکنند و نقش فزاینده متخصصان غیر ژنتیک را در تسهیل آزمایش ژنتیک، به ویژه برای هدایت درمان سرطان، تصدیق میکنند [52].
وقتی چنین افرادی شناسایی شدند، گزینههای متناسب با وضعیت بیمار در نظر گرفته میشوند.
در حال حاضر، استفاده از آزمایش واریانتهای بیماریزا برای شناسایی استعداد ژنتیکی به سرطان کولورکتال (CRC) به عنوان یک اقدام غربالگری در جمعیت عمومی توصیه نمیشود. نادر بودن واریانتهای بیماریزا در ژنهای مرتبط با سرطان کولورکتال و حساسیت محدود استراتژیهای آزمایش فعلی، آزمایش جمعیت عمومی را به طور بالقوه گمراهکننده و غیرمقرون به صرفه میکند.
توصیههای نسبتاً مفصلی برای نظارت در FAP و سندرم لینچ توسط چندین سازمان نماینده تخصصها و انجمنهای پزشکی مختلف ارائه شده است. این سازمانها شامل موارد زیر هستند:
- انجمن سرطان آمریکا [53]
- کارگروه چندجانبه ایالات متحده (انجمن گوارش آمریکا و انجمن آندوسکوپی دستگاه گوارش آمریکا) در مورد سرطان کولورکتال [54]
- انجمن جراحان روده بزرگ و رکتوم آمریکا [55]
- NCCN [56]
- بررسیهای ژنتیکی
- کالج آمریکایی گوارششناسی [57]
- انجمن انکولوژی زنان و کالج آمریکایی زنان و زایمان.
مبانی شواهد برای توصیهها عموماً در بیانیهها یا دستورالعملها گنجانده شدهاند. در بسیاری از موارد، این دستورالعملها منعکسکننده نظر متخصصان مبتنی بر مطالعاتی هستند که به ندرت کارآزماییهای تصادفی آیندهنگر هستند.
سرطان کولورکتال زودرس
اپیدمیولوژی سرطان کولورکتال (CRC) با توجه به سن تشخیص، در حال تغییر است و افراد به طور فزایندهای قبل از 55 سالگی تشخیص داده میشوند [1] که اغلب در غیاب پولیپوز و بدون سابقه خانوادگی سرطان کولورکتال است که نشان دهنده یک سندرم سرطان ارثی است [ 58-60]. یک مطالعه که شیوع واریانتهای بیماریزای بسیار نافذ را در 450 فرد مبتلا به سرطان کولورکتال زودرس (میانگین سن در زمان تشخیص، 42.5 سال) و سابقه خانوادگی شامل حداقل یک FDR مبتلا به سرطان روده بزرگ، آندومتر، پستان، تخمدان و/یا پانکراس بررسی کرد، 75 واریانت بیماریزای ژرملاین یا احتمالاً بیماریزا را در 72 بیمار (16٪) شناسایی کرد [58]. طیف واریانتهای شناسایی شده شامل ژنهای مرتبط با سندرم لینچ و غیر سندرم لینچ، از جمله چندین ژن که به طور سنتی با سرطان کولورکتال مرتبط نبودهاند (مانند BRCA1 / BRCA2 ، ATM ، CHEK2 PALB2 و CDKN2A) بود. با توجه به فراوانی بالا و تنوع سندرمهای سرطان ارثی شناساییشده، نویسندگان پیشنهاد کردند که آزمایش چندژنی (پانل) در این جمعیت ممکن است ضروری باشد.
در غیاب سابقه خانوادگی یا شخصی اضافی که نشان دهنده سندرم لینچ باشد، موارد جداگانه سرطان کولورکتال که قبل از 36 سالگی تشخیص داده میشوند، به طور غیرمعمول با واریانتهای بیماریزای ژن MMR مرتبط هستند. یک مطالعه واریانتهای بیماریزای MMR را تنها در 6.5٪ از این افراد نشان داد [59]، در حالی که مطالعه دیگری روی بیماران مبتلا به سرطان کولورکتال کمتر از 50 سال با بیش از یک FDR مبتلا به سرطان کولورکتال، ناپایداری غیرطبیعی ریزماهواره (MSI) را در 21٪ از تومورها و نقص بیش از حد در ژنهای PMS2 و MSH6 نشان داد [60]. بنابراین، به موارد جداگانه سرطان کولورکتال با شروع بسیار زودهنگام در غیاب پولیپوز، باید غربالگری تومور با MSI/ایمونوهیستوشیمی ارائه شود، نه اینکه مستقیماً به تجزیه و تحلیل واریانتهای بیماریزای رده زایا پرداخته شود.
استفاده از نمرات ریسک پلیژنیک (PRS) در زمینه سرطان کولورکتال زودرس در افرادی که آزمایش آنها برای انواع رایج حساسیت به سرطان کولورکتال منفی بوده است، در حال بررسی است، و دادههای حاصل از یک تجزیه و تحلیل بزرگ [61] نشان میدهد که ظرفیت پیشبینیکننده PRS 95 ژنی ممکن است به ویژه در ارزیابی خطر سرطان کولورکتال در بین افراد جوان (سن، کمتر از 50 سال) که فاقد سابقه خانوادگی سرطان کولورکتال در یکی از بستگان درجه یک خود هستند و در غیر این صورت طبق روال فعلی برای شروع زودهنگام غربالگری کولونوسکوپی انتخاب نمیشوند، قوی باشد.
دشواریهای شناسایی سابقه خانوادگی خطر ابتلا به سرطان کولورکتال
هنگام استفاده از سابقه خانوادگی برای ارزیابی خطر فردی در عمل بالینی و هنگام شناسایی خانوادههای مناسب برای تحقیقات سرطان، باید دقت و کامل بودن دادههای سابقه خانوادگی در نظر گرفته شود. سابقه خانوادگی گزارش شده ممکن است اشتباه باشد، یا فرد ممکن است از وجود بستگان مبتلا به سرطان بیاطلاع باشد.[62] افزایش استفاده از کولونوسکوپی ممکن است منجر به کاهش سرطان روده بزرگ (CRC) و افزایش پولیپهای روده بزرگ پیش سرطانی در سابقه خانوادگی شود. افراد بسیار کمتر از اینکه از سابقه خانوادگی سرطان خود مطلع باشند، از سابقه خانوادگی پولیپهای خود (یعنی نوع پولیپها و تعداد کل پولیپها در بستگانشان) مطلع هستند. علاوه بر این، اندازه کوچک خانواده و مرگهای زودرس ممکن است میزان آموزنده بودن سابقه خانوادگی را محدود کند. همچنین، به دلیل نفوذ ناقص، برخی از افراد ممکن است استعداد ژنتیکی ابتلا به سرطان روده بزرگ را داشته باشند اما به سرطان مبتلا نشوند و این تصور را ایجاد کند که نسلها در یک شجرهنامه از قلم افتادهاند.
دقت سابقه خانوادگی سرطان روده بزرگ گزارش شده توسط بیمار خوب نشان داده شده است، اما بهینه نیست. گزارش بیمار باید در صورت امکان با دریافت سوابق پزشکی تأیید شود، به خصوص برای سرطانهای دستگاه تناسلی که ممکن است در شناسایی خطر سندرم لینچ مرتبط باشند و توسط برخی از بیماران با اطمینان کمتری گزارش میشوند.
رویکردهای متعددی برای ارزیابی بیماری که به تازگی سرطان روده بزرگ در او تشخیص داده شده و ممکن است مشکوک به سندرم ژنتیک سرطان باشد یا نباشد، در دسترس است. پزشک ممکن است بر اساس سابقه خانوادگی و معاینه فیزیکی به یک استعداد ارثی بالقوه مشکوک شود و آزمایشهای ژنتیکی برای تأیید این سوءظنها در دسترس است. کالج آمریکایی ژنتیک و ژنومیک پزشکی دستورالعملهایی را برای ارزیابی بیماران مشکوک به سندرمهای مستعد سرطان روده بزرگ منتشر کرده است.[51] هدف این دستورالعملها شناسایی افرادی است که ویژگیهای بالینی آنها ارجاع به مشاوره ژنتیک را ایجاب میکند. اگر فردی پولیپهای متعدد (بیش از 20) داشته باشد، بسته به بافتشناسی، آزمایش اختصاصی ژنمحور میتواند یک ابزار تشخیصی مفید باشد. به طور مشابه، اگر تظاهرات بالینی بیمار مشکوک به سندرم لینچ باشد، آزمایش ژنتیکی ژرملاین میتواند به سمت این سندرم هدایت شود. با این حال، تشخیص زمانی که تصویر بالینی کمتر واضح باشد، چالش برانگیزتر است. در حال حاضر، غربالگری تومور برای سندرم لینچ رایجترین رویکرد پذیرفته شده است. با این حال، به طور فزایندهای، پنلهایی که انواع سوماتیک در تومورها را مشخص میکنند، برای انواع تصمیمات بالینی مورد استفاده قرار میگیرند.
آزمایش ارزیابی ریسک پیشینی (که ریسک را بر اساس عوامل مختلفی مانند سن شروع سرطان و طیف تومورهای خانواده مدلسازی میکند) ممکن است در بسیاری از موارد جایگزین مناسبی باشد. کاربرد چنین مدلهای ریسکی، استفاده از آزمایش چند ژنی (پانل) را پیشبینی میکند؛ با این حال، نقش دقیق آنها هنوز مشخص نشده است.
رویدادهای مولکولی مرتبط با سرطانزایی روده بزرگ
بخش عمدهای از درک اولیه ما از پاتوژنز مولکولی سرطان کولورکتال (CRC) از سندرمهای نادر ارثی سرطان کولورکتال ناشی شده و ناهمگونی سرطان کولورکتال را از نظر مولکولی و بالینی آشکار کرده است. به خوبی پذیرفته شده است که اکثر سرطانهای کولورکتال از آدنومها ایجاد میشوند. گذار از اپیتلیوم طبیعی به آدنوم و سپس به کارسینوم با رویدادهای مولکولی اکتسابی مرتبط است.[63-65] در حال حاضر، سرطان کولورکتال را میتوان بر اساس ویژگیهای ژنتیکی مولکولی مشابه به سه دسته تقسیم کرد که نشاندهنده مسیرهای متفاوت تومورزایی است: ناپایداری کروموزومی (CIN)، MSI و فنوتیپ متیلاتور جزیره CpG (CIMP). درک مسیرهای ژنتیکی مولکولی تومورزایی کولورکتال هنوز در حال تکامل است و هر سطح جدید از درک در چارچوب سطح قبلی دانش رخ داده است. علاوه بر این، این مسیرها از ناهمگونی بالینی و بافتشناسی مهم پولیپها و سرطانهای کولورکتال پدید آمدهاند. بنابراین، مقدمه زیر تکامل زمانی درک فعلی ما از تومورزایی کولورکتال را نشان میدهد.
مسیر ناپایداری کروموزومی (CIN)
بیشتر سرطانهای کولورکتال (CRC) از طریق مسیر CIN ایجاد میشوند. تغییرات کلیدی در سرطانهای CIN شامل تغییرات گسترده در تعداد کروموزومها (آنیوپلوئیدی) و از دست دادنهای مکرر و قابل تشخیص در سطح مولکولی بخشهایی از کروموزومها (از دست دادن هتروزیگوسیتی)، مانند 5q، 18q و 17p؛ و انواع بیماریزای انکوژن KRAS است. ژنهای مهم دخیل در این از دست دادن کروموزومها عبارتند از APC (5q)، DCC / MADH2 / MADH4 (18q) و TP53 (17p). [64 ،66] این از دست دادنهای کروموزومی نشان دهنده بیثباتی ژنتیکی در سطوح مولکولی و کروموزومی هستند. [65] از جمله اولین و رایجترین رویدادها در مسیر پیشرفت تومور کولورکتال، از دست دادن یا غیرفعال شدن انواع بیماریزا ژن APC است . اولین بار نشان داده شد که غیرفعال شدن APC در FAP، یک سندرم ارثی CRC که در آن افراد مبتلا دارای تغییرات APC رده زایا هستند و در نتیجه عملکرد آن از بین میرود و میزان بروز پولیپها و سرطانهای کولورکتال به طور چشمگیری افزایش مییابد، برای سرطان کولورکتال مهم است. انواع بیماریزای اکتسابی یا ارثی ژنهای ترمیم آسیب DNA، به عنوان مثال، ترمیم برش باز، ترمیم برش نوکلئوتیدی، ترمیم دو رشتهای و MMR، نیز در مستعد کردن سلولهای اپیتلیال کولورکتال به انواع بیماریزا نقش دارند.
مسیر ناپایداری ریزماهواره (MSI)
کمی پس از آن، زیرمجموعهای (10 تا 15 درصد) از سرطانهای کولورکتال (CRC) شناسایی شدند که فاقد شواهدی از بیثباتی کروموزومی بودند، اما در توالیهای تکرار ریزماهوارهای، ناهنجاریهایی را نشان میدادند، [67، 68] که از ویژگیهای تومورها در بیماران مبتلا به سندرم لینچ است. [69] بعداً مشخص شد که هایپرمتیلاسیون پروموتر MLH1 مسئول بسیاری از سرطانهای کولورکتال اسپورادیک با MSI است. واریانتهای ژرملاین در ژنهای MMR DNA در بیماران مبتلا به سندرم لینچ کشف شد که CRCهای آنها اغلب MSI را نشان میدادند. بنابراین، مسیر بیثباتی ریزماهوارهای (MSI، که گاهی اوقات به عنوان MIN نیز شناخته میشود) پیشنهاد شد.
ویژگیهای کلیدی سرطانهای MSI این است که آنها دارای یک مجموعه کروموزومی عمدتاً دستنخورده هستند و در نتیجه نقص در سیستم MMR DNA، به راحتی انواع بیماریزا را در ژنهای مهم و اغلب منحصر به فرد مرتبط با سرطان به دست میآورند. این نوع سرطانها در سطح مولکولی با تغییراتی در واحدهای تکراری DNA که به طور معمول در سراسر ژنوم وجود دارند، که به عنوان ریزماهوارههای DNA شناخته میشوند، قابل تشخیص هستند.
به نظر میرسد سرعت پیشرفت آدنوما به کارسینوما در تومورهای ناپایدار میکروستلایت سریعتر از تومورهای پایدار میکروستلایت است [70]. اساس این امر، گزارشهای مکرر از سرطانهای فاصلهای در بیمارانی است که اخیراً کولونوسکوپی طبیعی داشتهاند. تأیید بیشتر این موضوع در مسیر دندانهدار دیده میشود که در آن میزان بالای سرطان فاصلهای نیز مشاهده شده است [71، 72]. تغییرات بافتشناسی مشخص، مانند افزایش تولید موسین، را میتوان در تومورهایی که MSI، نفوذ لنفوسیتهای T داخل توموری/واکنش شبه کرون و غیره را نشان میدهند، مشاهده کرد که تومورهای کولورکتال را در این مسیر متمایز میکند.
دانش حاصل از مطالعه سندرمهای ارثی سرطان کولورکتال (CRC) سرنخهای مهمی در مورد وقایع مولکولی که واسطه شروع تومور و پیشرفت تومور در افراد بدون ناهنجاریهای رده زایا هستند، ارائه داده است. از جمله اولین وقایع در مسیر پیشرفت تومور کولورکتال (هم MSI و هم CIN) از دست دادن عملکرد محصول ژن APC است.
فنوتیپ متیلاتور جزیره CpG (CIMP) و مسیر پولیپوز دندانهدار
از دهه 1980، مطالعات شروع به گزارش افزایش خطر ابتلا به سرطان کولورکتال (CRC) در بیماران مبتلا به سندرم پولیپوز هیپرپلاستیک (HPS) کردند که اکنون به عنوان سندرم پولیپوز دندانهدار (SPS) شناخته میشود.[6، 7، 73-78] به نظر میرسد تنها تعداد کمی از SPSها خانوادگی هستند، اما تا به امروز هیچ گونه واریانت ژرملاین رایجی در این خانوادهها شناسایی نشده است. مقایسه پولیپهای هیپرپلاستیک (HPs) یافت شده در بیماران SPS و گروه کنترل نشان داد که پولیپهای SPS از نظر بافتشناسی متمایز هستند و شبیه به آدنومهای دندانهدار، پولیپهایی با ویژگیهای HPs و پولیپهای آدنوماتوز (APs) هستند که قبلاً شرح داده شدهاند.[79] این امر منجر به مشاهداتی شد که این آدنومهای دندانهدار بیثبات (SSA) تمایل دارند در روده بزرگ راست رخ دهند، جایی که اغلب بزرگ و بیثبات هستند و افزایش تکثیر، اتساع و دندانهدار شدن پایههای کریپت، کاهش سلولهای غدد درونریز و عدم دیسپلازی را نشان میدهند [80].
بررسیهای بافتشناسی بیشتر پولیپهای دندانهدار منجر به شناسایی زیرگروههایی شد: آدنومهای دندانهدار سنتی (TSA)، پولیپهای دندانهدار مختلط (MP) و اخیراً، آدنوم دندانهدار بیپایه/پولیپ دندانهدار بیپایه (SSA/SSP). [81] TSAها با مورفولوژی برآمده، تشکیل کریپتهای نابجا (نشانگر نقص سیگنالینگ پروتئین مورفوژنتیک استخوان) و هیستوپاتولوژی پرزدار و دیسپلاستیک مشخص میشوند. [80، 82] TSAها صرفاً SSAهای دارای دیسپلازی نیستند و شواهدی مبنی بر اینکه SSAها پیشساز TSAها هستند، وجود ندارد. MPها ویژگیهای همپوشانی HPها، SSAها و TSAها را دارند.
در مطالعات غربالگری کولونوسکوپی، پولیپهای بزرگ دندانهدار به شدت و به طور مستقل با ایجاد نئوپلاسمهای پیشرفته کولورکتال مرتبط بودند، در حالی که پولیپهای چپدست این ارتباط را نداشتند. اصطلاح SSA برای پزشکان نگرانکننده بوده است زیرا این پولیپها از نظر مشخصه فاقد آتیپی هستهای، مشخصه سنتی آدنومها، هستند، بلکه به دلیل سایر ویژگیهای ساختاری، آدنوم نامیده میشوند. طبقهبندی SSA با این دانش پشتیبانی میشود که ویژگیهای مولکولی نشاندهنده افزایش خطر سرطان هستند. [79، 83، 84]
در حالی که آدنومهای پراکنده (APs) در بیماران مبتلا به سندرم لینچ میتوانند MSI را نشان دهند، آدنومهای پراکنده به ندرت این اتفاق میافتند. با این حال، پولیپهای دندانهدار با دیسپلازی میتوانند MSI را با هیپرمتیلاسیون پروموتر MLH1 نشان دهند. پولیپهای دندانهدار بزرگ (>1 سانتیمتر ) خطر سرطان بیشتری نسبت به پولیپهای هیپرپلاستیک معمولی دارند و هنگام تبدیل شدن به سرطان، به طور مشخص MSI را نشان میدهند.[ 82 ، 85-87 ] در بررسی پولیپهای دندانهدار برداشته شده با کانون بدخیم، همه پولیپها از روده بزرگ راست منشأ گرفته و SSA بودند.[85] کانونهای بدخیم MSI بودند و از دست دادن واکنشپذیری ایمنی MLH1 را نشان دادند، که نشان دهنده ارتباط بین SSAها و سرطانهای روده بزرگ MSI پراکنده است.
MSI مشاهده شده در سرطانهای کولورکتال پراکنده (CRCs) به دلیل هیپرمتیلاسیون پروموتر MLH1 است که بیان آن را لغو میکند. از آنجایی که نواحی پروموتر سایر ژنهای سرکوبکننده تومور از طریق هیپرمتیلاسیون “خاموش” شدند، مطالعات ژنوم سرطان CRC آغاز شد. این مطالعات الگوی ثابتی از هیپرمتیلاسیون را در ژنهای ارزیابی شده در تقریباً 50٪ از سرطانهای کولورکتال نشان دادند.[88] مطالعات روی تعداد بیشتری از بیماران CRC انتخاب نشده نشان میدهد که اقلیتی از سرطانهای کولورکتال (20 تا 30 درصد) CIMP را نشان میدهند که به عنوان هیپرمتیلاسیون دو یا چند جزیره CpG در MINT1 ، MINT2 ، MINT31 ، CDKN2A ( p16 ) و MLH1 تعریف میشود [89، 90] اصطلاح CIMP برای طبقهبندی این سرطانها ابداع شد که ویژگیهای بالینی مشترکی داشتند. تلاشهای اولیه برای تمایز سرطانهای کولورکتال مثبت و منفی CIMP ناموفق بود [91]. با این حال، مطالعات بعدی با استفاده از تجزیه و تحلیل خوشهای سلسله مراتبی بیطرفانه ژنهای به شدت متیله شده در سرطانهای کولورکتال و یک طرح مطالعه مبتنی بر جمعیت، ویژگیهای بالینی و مولکولی منحصر به فردی را که از مسیر CIMP پشتیبانی میکنند، با موفقیت شناسایی کردند.[88، 92]
احتمال بیان MSI در سرطانهای کولورکتال با CIMP بالا (82.1%؛ P < .0001) بسیار بیشتر از سرطانهای کولورکتال با CIMP بالا (بیش از 2 نشانگر CIMP ذکر شده در بالا) بود. در یک مطالعه، تومورهای کولورکتال با CIMP بالا و پایدار با CIMP بالا (بیش از 2 نشانگر CIMP ذکر شده در بالا ) که با CIMP بالا و پایدار با CIMP بالا بودند، به طور قابل توجهی بیشتر با واریانتهای BRAF V600E، واریانتهای KRAS2 ، محل پروگزیمال، مرحله بالاتر کمیته مشترک سرطان آمریکا، سن بیمار بالاتر، تمایز ضعیف و بافتشناسی موکینوز مرتبط بودند تا تومورهای کولورکتال با CIMP پایین (کمتر از 2 نشانگر CIMP ذکر شده در بالا) [88]. تومورهای کولورکتال با CIMP بالا و ناپایدار با CIMP بالا و ناپایدار با CIMP بالا، به طور قابل توجهی بیشتر با واریانتهای بیماریزای BRAF V600E، محل پروگزیمال، سن بیمار بالاتر و عدم وجود واریانتهای بیماریزای KRAS2 مرتبط بودند تا تومورهای ناپایدار با CIMP پایین و ناپایدار با CIMP [88] حضور به طور قابل توجهی بیشتری وجود داشت واریانتهای بیماریزای BRAF V600E در تومورهای کولورکتال با CIMP بالا صرف نظر از MSI .[88] بنابراین، برخلاف مطالعه قبلی که اهمیت بیولوژیکی CIMP را پس از حذف تومورهای کولورکتال ناپایدار زیر سوال میبرد،[91] این مطالعه نشان داد که چندین متغیر کلینیکوپاتولوژیک در واقع با CIMP در تومورهای کولورکتال پایدار با ریزماهواره و ناپایدار با ریزماهواره مرتبط هستند [88].
مطالعات پولیپها، پولیپهای CIMP مثبت را در بیماران SPS و بیشتر در SSAهای سمت راست نشان داد [ 72،93-96] اخیراً، مشخص شده است که یک واریانت بیماریزای BRAF با کانونهای داغ (V600E) در سرطانهای روده بزرگ MSI و پولیپهای دندانهدار رایج است [97-99]. واریانت بیماریزای BRAF در سرطانهای کولورکتال بیماران سندرم لینچ وجود ندارد و در پولیپهای کولورکتال آدنوماتوز پراکنده نادر است، اما در اکثر قریب به اتفاق پولیپهای دندانهدار، به ویژه SSAها، وجود دارد.[ 94،96 ، 100-102] مثبت بودن CIMP معمولاً در پولیپهای هیپرپلاستیک میکرووزیکولار (MVHP) یافت میشود که نشان دهنده پیشرفت MVHP به SSA و سپس به سرطان روده بزرگ است [ 94 ].
نتیجهگیری
توصیف CRC های CIMP و شواهدی مبنی بر اینکه MSI بعداً در توالی آدنوم-کارسینوم رخ میدهد، منجر به اصلاح مدل تومورزایی کولورکتال قبلی میشود که از دو مسیر تشکیل شده بود: MSI (MIN) و CIN. همپوشانی زیادی بین مسیرهای MSI و CIMP وجود دارد. در قلب مسیر CIMP، پولیپهای دندانهدار حاوی انواع بیماریزای BRAF قرار دارند . مسیر CIN با پیشسازهای AP مشخص میشود که اکثریت قریب به اتفاق آنها حاوی انواع بیماریزای APC هستند که در اوایل مسیر رخ میدهند.
منابع
- American Cancer Society: Cancer Facts and Figures 2024. American Cancer Society, 2024. Available onlineExit Disclaimer. Last accessed December 30, 2024.
- Kanth P, Grimmett J, Champine M, et al.: Hereditary Colorectal Polyposis and Cancer Syndromes: A Primer on Diagnosis and Management. Am J Gastroenterol 112 (10): 1509-1525, 2017. [PUBMED Abstract]
- Lynch HT, Smyrk TC, Watson P, et al.: Genetics, natural history, tumor spectrum, and pathology of hereditary nonpolyposis colorectal cancer: an updated review. Gastroenterology 104 (5): 1535-49, 1993. [PUBMED Abstract]
- Rustgi AK: The genetics of hereditary colon cancer. Genes Dev 21 (20): 2525-38, 2007. [PUBMED Abstract]
- Howe JR, Mitros FA, Summers RW: The risk of gastrointestinal carcinoma in familial juvenile polyposis. Ann Surg Oncol 5 (8): 751-6, 1998. [PUBMED Abstract]
- Jeevaratnam P, Cottier DS, Browett PJ, et al.: Familial giant hyperplastic polyposis predisposing to colorectal cancer: a new hereditary bowel cancer syndrome. J Pathol 179 (1): 20-5, 1996. [PUBMED Abstract]
- Rashid A, Houlihan PS, Booker S, et al.: Phenotypic and molecular characteristics of hyperplastic polyposis. Gastroenterology 119 (2): 323-32, 2000. [PUBMED Abstract]
- Neugut AI, Jacobson JS, DeVivo I: Epidemiology of colorectal adenomatous polyps. Cancer Epidemiol Biomarkers Prev 2 (2): 159-76, 1993 Mar-Apr. [PUBMED Abstract]
- Shinya H, Wolff WI: Morphology, anatomic distribution and cancer potential of colonic polyps. Ann Surg 190 (6): 679-83, 1979. [PUBMED Abstract]
- Fenoglio CM, Lane N: The anatomical precursor of colorectal carcinoma. Cancer 34 (3): suppl:819-23, 1974. [PUBMED Abstract]
- Morson B: President’s address. The polyp-cancer sequence in the large bowel. Proc R Soc Med 67 (6): 451-7, 1974. [PUBMED Abstract]
- Muto T, Bussey HJ, Morson BC: The evolution of cancer of the colon and rectum. Cancer 36 (6): 2251-70, 1975. [PUBMED Abstract]
- Stryker SJ, Wolff BG, Culp CE, et al.: Natural history of untreated colonic polyps. Gastroenterology 93 (5): 1009-13, 1987. [PUBMED Abstract]
- O’Brien MJ, Winawer SJ, Zauber AG, et al.: The National Polyp Study. Patient and polyp characteristics associated with high-grade dysplasia in colorectal adenomas. Gastroenterology 98 (2): 371-9, 1990. [PUBMED Abstract]
- Winawer SJ, Stewart ET, Zauber AG, et al.: A comparison of colonoscopy and double-contrast barium enema for surveillance after polypectomy. National Polyp Study Work Group. N Engl J Med 342 (24): 1766-72, 2000. [PUBMED Abstract]
- Winawer SJ, Zauber AG, Ho MN, et al.: Prevention of colorectal cancer by colonoscopic polypectomy. The National Polyp Study Workgroup. N Engl J Med 329 (27): 1977-81, 1993. [PUBMED Abstract]
- Müller AD, Sonnenberg A: Prevention of colorectal cancer by flexible endoscopy and polypectomy. A case-control study of 32,702 veterans. Ann Intern Med 123 (12): 904-10, 1995. [PUBMED Abstract]
- O’brien MJ, Winawer SJ, Zauber AG, et al.: Flat adenomas in the National Polyp Study: is there increased risk for high-grade dysplasia initially or during surveillance? Clin Gastroenterol Hepatol 2 (10): 905-11, 2004. [PUBMED Abstract]
- Zauber AG, O’Brien MJ, Winawer SJ: On finding flat adenomas: is the search worth the gain? Gastroenterology 122 (3): 839-40, 2002. [PUBMED Abstract]
- Rembacken BJ, Fujii T, Cairns A, et al.: Flat and depressed colonic neoplasms: a prospective study of 1000 colonoscopies in the UK. Lancet 355 (9211): 1211-4, 2000. [PUBMED Abstract]
- Woolf CM: A genetic study of carcinoma of the large intestine. Am J Hum Genet 10 (1): 42-7, 1958. [PUBMED Abstract]
- Fuchs CS, Giovannucci EL, Colditz GA, et al.: A prospective study of family history and the risk of colorectal cancer. N Engl J Med 331 (25): 1669-74, 1994. [PUBMED Abstract]
- Slattery ML, Kerber RA: Family history of cancer and colon cancer risk: the Utah Population Database. J Natl Cancer Inst 86 (21): 1618-26, 1994. [PUBMED Abstract]
- Negri E, Braga C, La Vecchia C, et al.: Family history of cancer and risk of colorectal cancer in Italy. Br J Cancer 77 (1): 174-9, 1998. [PUBMED Abstract]
- St John DJ, McDermott FT, Hopper JL, et al.: Cancer risk in relatives of patients with common colorectal cancer. Ann Intern Med 118 (10): 785-90, 1993. [PUBMED Abstract]
- Duncan JL, Kyle J: Family incidence of carcinoma of the colon and rectum in north-east Scotland. Gut 23 (2): 169-71, 1982. [PUBMED Abstract]
- Rozen P, Fireman Z, Figer A, et al.: Family history of colorectal cancer as a marker of potential malignancy within a screening program. Cancer 60 (2): 248-54, 1987. [PUBMED Abstract]
- Johns LE, Houlston RS: A systematic review and meta-analysis of familial colorectal cancer risk. Am J Gastroenterol 96 (10): 2992-3003, 2001. [PUBMED Abstract]
- Cottet V, Pariente A, Nalet B, et al.: Colonoscopic screening of first-degree relatives of patients with large adenomas: increased risk of colorectal tumors. Gastroenterology 133 (4): 1086-92, 2007. [PUBMED Abstract]
- Winawer SJ, Zauber AG, Gerdes H, et al.: Risk of colorectal cancer in the families of patients with adenomatous polyps. National Polyp Study Workgroup. N Engl J Med 334 (2): 82-7, 1996. [PUBMED Abstract]
- Ahsan H, Neugut AI, Garbowski GC, et al.: Family history of colorectal adenomatous polyps and increased risk for colorectal cancer. Ann Intern Med 128 (11): 900-5, 1998. [PUBMED Abstract]
- Win AK, Macinnis RJ, Hopper JL, et al.: Risk prediction models for colorectal cancer: a review. Cancer Epidemiol Biomarkers Prev 21 (3): 398-410, 2012. [PUBMED Abstract]
- Chen S, Wang W, Lee S, et al.: Prediction of germline mutations and cancer risk in the Lynch syndrome. JAMA 296 (12): 1479-87, 2006. [PUBMED Abstract]
- Balmaña J, Stockwell DH, Steyerberg EW, et al.: Prediction of MLH1 and MSH2 mutations in Lynch syndrome. JAMA 296 (12): 1469-78, 2006. [PUBMED Abstract]
- Barnetson RA, Tenesa A, Farrington SM, et al.: Identification and survival of carriers of mutations in DNA mismatch-repair genes in colon cancer. N Engl J Med 354 (26): 2751-63, 2006. [PUBMED Abstract]
- Burt RW: Colon cancer screening. Gastroenterology 119 (3): 837-53, 2000. [PUBMED Abstract]
- Burt RW, Petersen GM: Familial colorectal cancer: diagnosis and management. In: Young GP, Rozen P, Levin B, eds.: Prevention and Early Detection of Colorectal Cancer. WB Saunders, 1996, pp 171-194.
- Mork ME, You YN, Ying J, et al.: High Prevalence of Hereditary Cancer Syndromes in Adolescents and Young Adults With Colorectal Cancer. J Clin Oncol 33 (31): 3544-9, 2015. [PUBMED Abstract]
- Kinzler KW, Nilbert MC, Su LK, et al.: Identification of FAP locus genes from chromosome 5q21. Science 253 (5020): 661-5, 1991. [PUBMED Abstract]
- Groden J, Thliveris A, Samowitz W, et al.: Identification and characterization of the familial adenomatous polyposis coli gene. Cell 66 (3): 589-600, 1991. [PUBMED Abstract]
- Leppert M, Burt R, Hughes JP, et al.: Genetic analysis of an inherited predisposition to colon cancer in a family with a variable number of adenomatous polyps. N Engl J Med 322 (13): 904-8, 1990. [PUBMED Abstract]
- Spirio L, Olschwang S, Groden J, et al.: Alleles of the APC gene: an attenuated form of familial polyposis. Cell 75 (5): 951-7, 1993. [PUBMED Abstract]
- Brensinger JD, Laken SJ, Luce MC, et al.: Variable phenotype of familial adenomatous polyposis in pedigrees with 3′ mutation in the APC gene. Gut 43 (4): 548-52, 1998. [PUBMED Abstract]
- Soravia C, Berk T, Madlensky L, et al.: Genotype-phenotype correlations in attenuated adenomatous polyposis coli. Am J Hum Genet 62 (6): 1290-301, 1998. [PUBMED Abstract]
- Pedemonte S, Sciallero S, Gismondi V, et al.: Novel germline APC variants in patients with multiple adenomas. Genes Chromosomes Cancer 22 (4): 257-67, 1998. [PUBMED Abstract]
- Sieber OM, Lamlum H, Crabtree MD, et al.: Whole-gene APC deletions cause classical familial adenomatous polyposis, but not attenuated polyposis or “multiple” colorectal adenomas. Proc Natl Acad Sci U S A 99 (5): 2954-8, 2002. [PUBMED Abstract]
- Leach FS, Nicolaides NC, Papadopoulos N, et al.: Mutations of a mutS homolog in hereditary nonpolyposis colorectal cancer. Cell 75 (6): 1215-25, 1993. [PUBMED Abstract]
- Papadopoulos N, Nicolaides NC, Wei YF, et al.: Mutation of a mutL homolog in hereditary colon cancer. Science 263 (5153): 1625-9, 1994. [PUBMED Abstract]
- Nicolaides NC, Papadopoulos N, Liu B, et al.: Mutations of two PMS homologues in hereditary nonpolyposis colon cancer. Nature 371 (6492): 75-80, 1994. [PUBMED Abstract]
- Miyaki M, Konishi M, Tanaka K, et al.: Germline mutation of MSH6 as the cause of hereditary nonpolyposis colorectal cancer. Nat Genet 17 (3): 271-2, 1997. [PUBMED Abstract]
- Hampel H, Bennett RL, Buchanan A, et al.: A practice guideline from the American College of Medical Genetics and Genomics and the National Society of Genetic Counselors: referral indications for cancer predisposition assessment. Genet Med 17 (1): 70-87, 2015. [PUBMED Abstract]
- Bashford MT, Kohlman W, Everett J, et al.: Addendum: A practice guideline from the American College of Medical Genetics and Genomics and the National Society of Genetic Counselors: referral indications for cancer predisposition assessment. Genet Med 21 (12): 2844, 2019. [PUBMED Abstract]
- Smith RA, Cokkinides V, Eyre HJ: American Cancer Society guidelines for the early detection of cancer, 2006. CA Cancer J Clin 56 (1): 11-25; quiz 49-50, 2006 Jan-Feb. [PUBMED Abstract]
- Winawer S, Fletcher R, Rex D, et al.: Colorectal cancer screening and surveillance: clinical guidelines and rationale-Update based on new evidence. Gastroenterology 124 (2): 544-60, 2003. [PUBMED Abstract]
- Church J, Simmang C; Standards Task Force, et al.: Practice parameters for the treatment of patients with dominantly inherited colorectal cancer (familial adenomatous polyposis and hereditary nonpolyposis colorectal cancer). Dis Colon Rectum 46 (8): 1001-12, 2003. [PUBMED Abstract]
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Genetic/Familial High-Risk Assessment: Colorectal, Endometrial, and Gastric. Version 3.2024. Plymouth Meeting, PA: National Comprehensive Cancer Network, 2024. Available with free registration.Exit Disclaimer Last accessed December 13, 2024.
- Syngal S, Brand RE, Church JM, et al.: ACG clinical guideline: Genetic testing and management of hereditary gastrointestinal cancer syndromes. Am J Gastroenterol 110 (2): 223-62; quiz 263, 2015. [PUBMED Abstract]
- Pearlman R, Frankel WL, Swanson B, et al.: Prevalence and Spectrum of Germline Cancer Susceptibility Gene Mutations Among Patients With Early-Onset Colorectal Cancer. JAMA Oncol 3 (4): 464-471, 2017. [PUBMED Abstract]
- Jasperson KW, Vu TM, Schwab AL, et al.: Evaluating Lynch syndrome in very early onset colorectal cancer probands without apparent polyposis. Fam Cancer 9 (2): 99-107, 2010. [PUBMED Abstract]
- Goel A, Nagasaka T, Spiegel J, et al.: Low frequency of Lynch syndrome among young patients with non-familial colorectal cancer. Clin Gastroenterol Hepatol 8 (11): 966-71, 2010. [PUBMED Abstract]
- Archambault AN, Su YR, Jeon J, et al.: Cumulative Burden of Colorectal Cancer-Associated Genetic Variants Is More Strongly Associated With Early-Onset vs Late-Onset Cancer. Gastroenterology 158 (5): 1274-1286.e12, 2020. [PUBMED Abstract]
- Glanz K, Grove J, Le Marchand L, et al.: Underreporting of family history of colon cancer: correlates and implications. Cancer Epidemiol Biomarkers Prev 8 (7): 635-9, 1999. [PUBMED Abstract]
- Fearon ER, Vogelstein B: A genetic model for colorectal tumorigenesis. Cell 61 (5): 759-67, 1990. [PUBMED Abstract]
- Vogelstein B, Kinzler KW: The multistep nature of cancer. Trends Genet 9 (4): 138-41, 1993. [PUBMED Abstract]
- Lengauer C, Kinzler KW, Vogelstein B: Genetic instabilities in human cancers. Nature 396 (6712): 643-9, 1998. [PUBMED Abstract]
- Kinzler KW, Vogelstein B: Colorectal tumors. In: Vogelstein B, Kinzler KW, eds.: The Genetic Basis of Human Cancer. 2nd ed. McGraw-Hill, 2002, pp 583-612.
- Thibodeau SN, Bren G, Schaid D: Microsatellite instability in cancer of the proximal colon. Science 260 (5109): 816-9, 1993. [PUBMED Abstract]
- Ionov Y, Peinado MA, Malkhosyan S, et al.: Ubiquitous somatic mutations in simple repeated sequences reveal a new mechanism for colonic carcinogenesis. Nature 363 (6429): 558-61, 1993. [PUBMED Abstract]
- Peltomäki P, Lothe RA, Aaltonen LA, et al.: Microsatellite instability is associated with tumors that characterize the hereditary non-polyposis colorectal carcinoma syndrome. Cancer Res 53 (24): 5853-5, 1993. [PUBMED Abstract]
- Jass JR, Cottier DS, Pokos V, et al.: Mixed epithelial polyps in association with hereditary non-polyposis colorectal cancer providing an alternative pathway of cancer histogenesis. Pathology 29 (1): 28-33, 1997. [PUBMED Abstract]
- Jass JR: Serrated route to colorectal cancer: back street or super highway? J Pathol 193 (3): 283-5, 2001. [PUBMED Abstract]
- Wynter CV, Walsh MD, Higuchi T, et al.: Methylation patterns define two types of hyperplastic polyp associated with colorectal cancer. Gut 53 (4): 573-80, 2004. [PUBMED Abstract]
- Bengoechea O, Martínez-Peñuela JM, Larrínaga B, et al.: Hyperplastic polyposis of the colorectum and adenocarcinoma in a 24-year-old man. Am J Surg Pathol 11 (4): 323-7, 1987. [PUBMED Abstract]
- Hyman NH, Anderson P, Blasyk H: Hyperplastic polyposis and the risk of colorectal cancer. Dis Colon Rectum 47 (12): 2101-4, 2004. [PUBMED Abstract]
- Leggett BA, Devereaux B, Biden K, et al.: Hyperplastic polyposis: association with colorectal cancer. Am J Surg Pathol 25 (2): 177-84, 2001. [PUBMED Abstract]
- McCann BG: A case of metaplastic polyposis of the colon associated with focal adenomatous change and metachronous adenocarcinomas. Histopathology 13 (6): 700-2, 1988. [PUBMED Abstract]
- Place RJ, Simmang CL: Hyperplastic-adenomatous polyposis syndrome. J Am Coll Surg 188 (5): 503-7, 1999. [PUBMED Abstract]
- Koide N, Saito Y, Fujii T, et al.: A case of hyperplastic polyposis of the colon with adenocarcinomas in hyperplastic polyps after long-term follow-up. Endoscopy 34 (6): 499-502, 2002. [PUBMED Abstract]
- Torlakovic E, Snover DC: Serrated adenomatous polyposis in humans. Gastroenterology 110 (3): 748-55, 1996. [PUBMED Abstract]
- Torlakovic EE, Gomez JD, Driman DK, et al.: Sessile serrated adenoma (SSA) vs. traditional serrated adenoma (TSA). Am J Surg Pathol 32 (1): 21-9, 2008. [PUBMED Abstract]
- Snover DC, Jass JR, Fenoglio-Preiser C, et al.: Serrated polyps of the large intestine: a morphologic and molecular review of an evolving concept. Am J Clin Pathol 124 (3): 380-91, 2005. [PUBMED Abstract]
- Lash RH, Genta RM, Schuler CM: Sessile serrated adenomas: prevalence of dysplasia and carcinoma in 2139 patients. J Clin Pathol 63 (8): 681-6, 2010. [PUBMED Abstract]
- Torlakovic E, Skovlund E, Snover DC, et al.: Morphologic reappraisal of serrated colorectal polyps. Am J Surg Pathol 27 (1): 65-81, 2003. [PUBMED Abstract]
- Jass JR, Baker K, Zlobec I, et al.: Advanced colorectal polyps with the molecular and morphological features of serrated polyps and adenomas: concept of a ‘fusion’ pathway to colorectal cancer. Histopathology 49 (2): 121-31, 2006. [PUBMED Abstract]
- Goldstein NS: Small colonic microsatellite unstable adenocarcinomas and high-grade epithelial dysplasias in sessile serrated adenoma polypectomy specimens: a study of eight cases. Am J Clin Pathol 125 (1): 132-45, 2006. [PUBMED Abstract]
- Lu FI, van Niekerk de W, Owen D, et al.: Longitudinal outcome study of sessile serrated adenomas of the colorectum: an increased risk for subsequent right-sided colorectal carcinoma. Am J Surg Pathol 34 (7): 927-34, 2010. [PUBMED Abstract]
- Schreiner MA, Weiss DG, Lieberman DA: Proximal and large hyperplastic and nondysplastic serrated polyps detected by colonoscopy are associated with neoplasia. Gastroenterology 139 (5): 1497-502, 2010. [PUBMED Abstract]
- Toyota M, Ahuja N, Ohe-Toyota M, et al.: CpG island methylator phenotype in colorectal cancer. Proc Natl Acad Sci U S A 96 (15): 8681-6, 1999. [PUBMED Abstract]
- Ahuja N, Mohan AL, Li Q, et al.: Association between CpG island methylation and microsatellite instability in colorectal cancer. Cancer Res 57 (16): 3370-4, 1997. [PUBMED Abstract]
- Samowitz WS, Albertsen H, Herrick J, et al.: Evaluation of a large, population-based sample supports a CpG island methylator phenotype in colon cancer. Gastroenterology 129 (3): 837-45, 2005. [PUBMED Abstract]
- Yamashita K, Dai T, Dai Y, et al.: Genetics supersedes epigenetics in colon cancer phenotype. Cancer Cell 4 (2): 121-31, 2003. [PUBMED Abstract]
- Weisenberger DJ, Siegmund KD, Campan M, et al.: CpG island methylator phenotype underlies sporadic microsatellite instability and is tightly associated with BRAF mutation in colorectal cancer. Nat Genet 38 (7): 787-93, 2006. [PUBMED Abstract]
- Chan AO, Issa JP, Morris JS, et al.: Concordant CpG island methylation in hyperplastic polyposis. Am J Pathol 160 (2): 529-36, 2002. [PUBMED Abstract]
- Kambara T, Simms LA, Whitehall VL, et al.: BRAF mutation is associated with DNA methylation in serrated polyps and cancers of the colorectum. Gut 53 (8): 1137-44, 2004. [PUBMED Abstract]
- O’Brien MJ, Yang S, Clebanoff JL, et al.: Hyperplastic (serrated) polyps of the colorectum: relationship of CpG island methylator phenotype and K-ras mutation to location and histologic subtype. Am J Surg Pathol 28 (4): 423-34, 2004. [PUBMED Abstract]
- Yang S, Farraye FA, Mack C, et al.: BRAF and KRAS Mutations in hyperplastic polyps and serrated adenomas of the colorectum: relationship to histology and CpG island methylation status. Am J Surg Pathol 28 (11): 1452-9, 2004. [PUBMED Abstract]
- Chan TL, Zhao W, Leung SY, et al.: BRAF and KRAS mutations in colorectal hyperplastic polyps and serrated adenomas. Cancer Res 63 (16): 4878-81, 2003. [PUBMED Abstract]
- Rajagopalan H, Bardelli A, Lengauer C, et al.: Tumorigenesis: RAF/RAS oncogenes and mismatch-repair status. Nature 418 (6901): 934, 2002. [PUBMED Abstract]
- Yuen ST, Davies H, Chan TL, et al.: Similarity of the phenotypic patterns associated with BRAF and KRAS mutations in colorectal neoplasia. Cancer Res 62 (22): 6451-5, 2002. [PUBMED Abstract]
- Deng G, Bell I, Crawley S, et al.: BRAF mutation is frequently present in sporadic colorectal cancer with methylated hMLH1, but not in hereditary nonpolyposis colorectal cancer. Clin Cancer Res 10 (1 Pt 1): 191-5, 2004. [PUBMED Abstract]
- McGivern A, Wynter CV, Whitehall VL, et al.: Promoter hypermethylation frequency and BRAF mutations distinguish hereditary non-polyposis colon cancer from sporadic MSI-H colon cancer. Fam Cancer 3 (2): 101-7, 2004. [PUBMED Abstract]
- Wang L, Cunningham JM, Winters JL, et al.: BRAF mutations in colon cancer are not likely attributable to defective DNA mismatch repair. Cancer Res 63 (17): 5209-12, 2003. [PUBMED Abstract]
تهیه و تنظیم: سید طه نوربخش
نظارت و تأیید: فائزه محمدهاشم-متخصص ژنتیک