فقط یک دهه پیش یا بیشتر، ایمونوتراپی یک روش جدید هیجانانگیز برای درمان برخی از افراد مبتلا به اشکال بسیار پیشرفته برخی از انواع سرطان در نظر گرفته میشد. امروزه، این روش سنگ بنای درمان سرطان است.
نوعی از ایمونوتراپی که هیجان فوقالعادهای ایجاد کرده است، درمانهای CAR T-cell است. اگرچه درمانهای CAR T-cell برای همه مؤثر نیستند، اما در برخی از افراد مبتلا به سرطان پیشرفته میتوانند بیماری را به طور کامل ریشهکن کنند، اغلب برای مدت طولانی.
اما آنچه درمانهای CAR T-cell را از سایر ایمونوتراپیها – و سایر درمانهای سرطان – متمایز میکند، این است که آنها از سلولهای T خود بیمار ساخته میشوند، که قاتل اصلی بدن برای سلولهای آلوده و سایر سلولهای بیمار هستند.
سازمان غذا و داروی آمریکا (FDA) اولین درمان با سلولهای T مبتنی بر CAR را در سال ۲۰۱۷ برای درمان کودکان مبتلا به لوسمی لنفوبلاستیک حاد (ALL) تأیید کرد. از آن زمان، روشهای دیگری نیز برای درمان بزرگسالان مبتلا به سرطانهای خون مانند لنفوم غیر هوچکین و میلومای چندگانه تأیید شدهاند.
دکتر استیون روزنبرگ از NCI و از پیشگامان ایمونوتراپی و درمان با CAR T-Cell میگوید: با این حال، برای مدت طولانی، در میان برخی از اعضای جامعه تحقیقاتی تردیدهایی وجود داشت که آیا درمان با CAR T-Cell و «درمانهای سلولی» مشابه، چیزی بیش از درمانهای خاص برای تعداد کمی از بیماران خواهد بود یا خیر . اما اکنون، «CAR T-Cell به بخشی از پزشکی مدرن تبدیل شدهاند.»
آنچه در این مطلب خواهید خواند
یک «داروی زنده»
همانطور که از نامشان پیداست، سلولهای T شاکله اصلی درمان CAR T-cell هستند. و از آنجا که در این روش از سلولهای T جمعآوریشده از بیمار استفاده میشود، دکتر رنیر جی. برنتجنس، از مرکز جامع سرطان راسول پارک در بوفالو، نیویورک، یکی دیگر از پیشگامان اولیه در زمینه CAR T-cell، توضیح داد: «ما با این نوع درمان، یک داروی زنده به بیماران میدهیم.»
ساخت این درمانها با جمعآوری خون از بیمار و جداسازی سلولهای T آغاز میشود. سپس این سلولها به یکی از آزمایشگاههای تولیدکننده درمان ارسال میشوند، جایی که از نظر ژنتیکی مهندسی میشوند تا پروتئینهای خاصی را روی سطح خود به نام گیرندههای آنتیژن کایمریک یا CAR تولید کنند.
گیرندههای CAR به سلولها کمک میکنند تا به پروتئینهای خاصی که به عنوان آنتیژن شناخته میشوند و در سلولهای سرطانی (و برخی سلولهای طبیعی) وجود دارند، بچسبند. آنها همچنین توانایی سلولهای T را در کشتن سلولهای سرطانی افزایش میدهند.
چه چیزی در سلول T-CAR وجود دارد؟
اگرچه تفاوتهای مهمی بین هر یک از درمانهای تأیید شده با CAR T-Cell وجود دارد که میتواند بر نحوه عملکرد آنها در بیماران تأثیر بگذارد، اما آنها اجزا و طرحهای مشابهی را به اشتراک میگذارند.
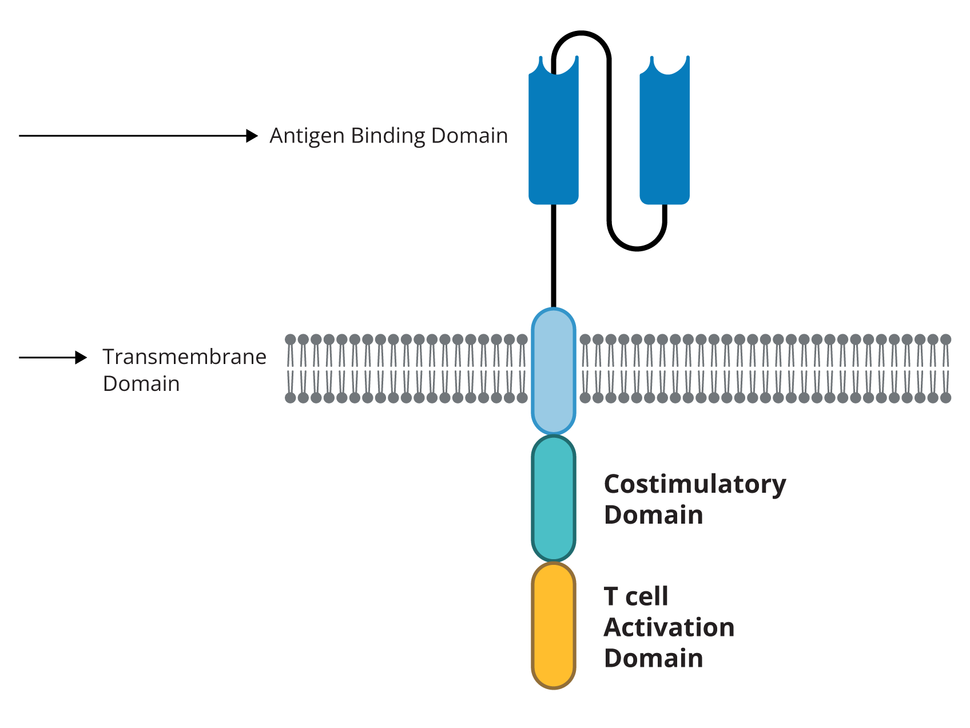
- هر گیرندهی CAR روی یک سلول T منفرد، غشای سلولی را در بر میگیرد، به طوری که بخشی از گیرنده در خارج از سلول و بخشی دیگر در داخل سلول قرار دارد.
- بخش خارجی CAR از قطعات یا دمینهایی از آنتیبادی ساختهشده است. اینکه کدام دمین استفاده شوند، بر توانایی گیرنده در شناسایی یا اتصال به آنتیژن هدف خود در سلولهای تومور تأثیر میگذارد.
- بخش داخلی هر گیرندهی CAR دارای دمینهای «سیگنالدهی» و «کمک تحریکی» است. پس از اتصال گیرنده به آنتیژن روی سلول تومور، این دمینها سیگنالهایی را درون سلولهای T منتقل میکنند که به آنها کمک میکند تا در بدن بیشتر تکثیر شوند.
در مرحله بعد، این سلولهای T اصلاحشده رشد داده میشوند یا “گسترش مییابند” تا زمانی که صدها میلیون از آنها وجود داشته باشد. این سلولهای گسترشیافته، محصول نهایی درمان CAR T-cell هستند که به بیمارستان فرستاده میشوند تا به صورت یک تزریق واحد به بیمار بازگردانده شوند.
در حال حاضر، کل این فرآیند – از جمعآوری اولیه خون تا تزریق مجدد سلولها به بیمار – حدود ۳ تا ۵ هفته طول میکشد.
پس از تزریق، اگر همه چیز طبق برنامه پیش برود، سلولهای T به گسترش خود در بدن بیمار ادامه میدهند و با هدایت گیرندههای ویژه خود، هر سلول سرطانی را که آنتیژن هدف را روی سطح خود داشته باشد، از بین میبرند.
درمانهای CAR T-cell برای بزرگسالان و کودکان
بیش از ۸۰٪ از کودکانی که به ALL ناشی از سلولهای B مبتلا میشوند، با شیمیدرمانی فشرده درمان میشوند. اما سالها هیچ درمان مؤثری برای کودکانی که سرطان آنها پس از شیمیدرمانی یا پیوند سلولهای بنیادی عود میکرد، وجود نداشت.
تأیید اولین درمان CAR T-cell، بر اساس کارآزماییهای بالینی بود که نشان داد این درمان، لوسمی را در اکثر کودکان مبتلا به ALL عودکننده از بین میبرد. مطالعات طولانیمدت نشان دادهاند که بسیاری از این کودکان سالها بدون بازگشت سرطان زنده میمانند. به عبارت دیگر، به نظر میرسد که آنها درمان شدهاند.
این درمان که tisa-cel نیز نامیده میشود، اکنون یک درمان استاندارد و توصیهشده برای کودکان مبتلا به ALL است که پس از درمانهای متعدد دیگر، بیماریشان عود کرده است.
درمانهای CAR T-cell که از آن زمان تاکنون تأیید شدهاند، همگی برای بزرگسالان مبتلا به سرطان خون، از جمله میلومای چندگانه و چندین نوع لنفوم، هستند. باز هم، این تأییدیهها بر اساس کارآزماییهای بالینی بزرگی بود که نشان میداد این درمانها میتوانند سرطانهای بسیار پیشرفته را برای مدتی در بسیاری از بیماران از بین ببرند و حتی در برخی موارد، درمانهای ظاهری ایجاد کنند.
دکتر جیمز کوچندرفِر از NCI، که چندین آزمایش بالینی در مورد درمانهای CAR T-cell را رهبری کرده است، توضیح داد که این درمانها برای بسیاری از بزرگسالان مبتلا به سرطان خون متحولکننده بودهاند.
دکتر کوچندفر گفت، در میان ذینفعان، افرادی با لنفوم پیشرفته هستند که بیماری آنها با سایر درمانهای استاندارد قابل کنترل نیست. قبل از اینکه درمانهای CAR T-Cell در دسترس قرار گیرد، بسیاری از این بیماران «عملاً غیرقابل درمان بودند». اما دیگر اینطور نیست.
برای مثال، در یک کارآزمایی بالینی که افراد مبتلا به لنفوم فولیکولار پیشرفته را درگیر کرده بود، درمان با CAR T-Cell (axi-cel (Yescarta)) سرطان را در تقریباً 80٪ از بیماران در این کارآزمایی از بین برد و طبق آخرین بهروزرسانی از این کارآزمایی، بیماری در بسیاری از این بیماران 3 سال بعد برنگشت.
و در آزمایشهای بالینی که شامل افراد مبتلا به لنفوم سلول بزرگ، شایعترین نوع این بیماری، بود، بیش از 30٪ از شرکتکنندگان 5 سال پس از درمان بدون هیچ نشانهای از سرطان زنده بودند.درمانهای CAR T-Cell مورد تایید FDA
| درمان با سلولهای T CAR | استفاده(های) تأیید شده |
|---|---|
| Abecma (ide-cel) | مولتیپل میلوما (میلومای چندگانه) |
| Aucatzyl (obe-cel) | سرطان خون ALL سلول B (بزرگسالان) |
| Breyanzi (liso-cel) | لنفوم فولیکولار لنفوم سلول B بزرگ لنفوم سلول مانتل لوسمی لنفوسیتی مزمن |
| Carvykti (cilta-cel) | مولتیپل میلوما (میلومای چندگانه) |
| Kymriah (tisa-cel) | سرطان خون ALL سلول B (کودکان/جوانان) لنفوم سلول B بزرگ منتشر لنفوم فولیکولار |
| Tecartus (brexu-cel) | سرطان خون ALL سلول B (بزرگسالان) لنفوم سلول مانتل |
| Yescarta (axi-cel) | لنفوم سلول B بزرگ لنفوم فولیکولار |
مدیریت عوارض جانبی درمانهای CAR T-cell
مانند تمام درمانهای سرطان، درمانهای CAR T cell میتوانند عوارض جانبی شدیدی ایجاد کنند. از جمله رایجترین عوارض این ایمونوتراپیها میتوان به عفونتها و مرگ دستهجمعی سلولهای B تولیدکننده آنتیبادی اشاره کرد.
دکتر جنیفر برودنو از NCI که در زمینه درمانهای CAR T-cell برای سرطانهای خون مطالعه میکند، توضیح داد که دو عارضه جانبی دیگر که نگرانیهای خاصی را ایجاد میکنند، سندرم آزادسازی سیتوکین (CRS) و مشکلات عصبی هستند که در مجموع سندرم نوروتوکسیسیتی مرتبط با سلولهای مؤثر ایمنی (ICANS) نامیده میشوند.
در مورد CRS، سلولهای T تزریقشده، جریان خون را با سیتوکینها، که پیامرسانهای شیمیایی هستند و به تحریک و هدایت پاسخ ایمنی کمک میکنند، پر میکنند. با این حال، فراوانی بیش از حد سیتوکینها که با CRS اتفاق میافتد، باعث تبهای بسیار بالا و خطرناک و افت شدید فشار خون میشود. در موارد نادر، CRS شدید میتواند کشنده باشد.
دکتر برودنو گفت، در بسیاری از بیماران، چه کودکان و چه بزرگسالان، CRS را میتوان با توسیلیزومب (Actemra) و در صورت نیاز، استروئیدها مدیریت کرد. توسیلیزومب که در ابتدا برای درمان بیماریهای التهابی مانند آرتریت نوجوانان استفاده میشد، فعالیت IL-6، سیتوکینی که اغلب به مقدار زیاد توسط سلولهای ایمنی ترشح میشود، را مسدود میکند.
برخی از نشانههای بارز ICANS شامل گیجی، خوابآلودگی بیش از حد و اختلال در گفتار است. دکتر برودنو توضیح داد که ICANS اغلب با استروئیدها نیز درمان میشود.
وقتی استروئیدها برای کنترل ICANS مؤثر نیستند، مطالعات متعددی نشان دادهاند که آناکینرا (Kineret)، یک داروی آنتیبادی که برای درمان آرتریت روماتوئید استفاده میشود، ممکن است گزینه مؤثری باشد. مطالعات دیگر نشان دادهاند که تجویز آناکینرا اندکی پس از درمان با CAR T-Cell ممکن است به جلوگیری از ICANS یا کاهش شدت آن کمک کند.
نزدیک شدن به درمان تومورهای جامد با CAR T-Cell
برخلاف پیشرفتهای حاصل در درمانهای CAR T-cell برای سرطانهای خون، پیشرفت در توسعهی آنها برای تومورهای جامد کند بوده است.
دکتر روزنبرگ گفت بخشی از مشکل این است که محققان در شناسایی آنتیژنهایی که در سطح سلولهای سرطانی در تومورهای جامد وجود دارند اما در سلولهای سالم وجود ندارند و همچنین کاندیداهای خوبی برای هدف قرار دادن با CAR هستند، با مشکل مواجه بودهاند.
مانع اصلی دیگر، محیط سرکوبکننده سیستم ایمنی در داخل و اطراف تومورها است. به عنوان مثال، سلولهای تومور و سایر اجزای سیستم ایمنی مولکولهایی تولید میکنند که میتوانند باعث اختلال در عملکرد CAR T-Cell شوند یا از رسیدن آنها به تومور جلوگیری کنند.
دکتر کریستال مککال، مدیر موسسه ایمونوتراپی سرطان پارکر در دانشگاه استنفورد، گفت: شاید بزرگترین مانع، «یک مشکل قدیمی: ناهمگونی تومور» باشد.
تومورهای جامد از یک نوع سرطان میتوانند از نظر مولکولی از بیماری به بیمار دیگر و حتی در یک بیمار کاملاً متفاوت باشند. به عنوان مثال، ممکن است هیچ آنتیژن قابل هدفگیری روی برخی از سلولهای تومور وجود نداشته باشد، یا تعداد آنها برای عملکرد سلولهای CAR T به اندازه کافی نباشد.
اما ممکن است ورق به نفع تومورهای جامد برگردد.
برای مثال، گروه دکتر مککال در استنفورد، نتایج امیدوارکنندهای را از یک کارآزمایی بالینی کوچک از درمان با CAR T-Cell در برخی از کودکان و بزرگسالان جوان مبتلا به سرطان کشنده مغز به نام گلیومای منتشر خط میانی گزارش کردهاند. یک تیم تحقیقاتی دیگر نیز یافتههای دلگرمکنندهای را با استفاده از یک درمان متفاوت با CAR T-Cell در کودکان مبتلا به این سرطانها گزارش کرده است.
نتایج مثبتی نیز در کارآزماییهای بالینی کوچک که درمانهای CAR T-Cell را در افراد مبتلا به سایر سرطانهای جامد، از جمله سرطانهای تخمدان و روده بزرگ، آزمایش میکنند، مشاهده شده است.
دکتر مککال گفت: «فکر میکنم همه ما در این زمینه میدانیم که ما فقط نوک کوه یخ را در مورد آنچه میتوانیم در رابطه با مهندسی CAR T-Cell انجام دهیم، خراشیدهایم. رویکردهای نسل بعدی بسیار بسیار زیادی برای مشکلاتی که [اثربخشی] آنها را در تومورهای جامد محدود میکنند، وجود دارد.»
بعدش چی میشه؟
تحقیقات در مورد اصلاح درمانهای CAR T-cell با سرعت زیادی در حال انجام است.
برای مثال، محققان درمانهای CAR T-cell را طوری طراحی کردهاند که عوارض جانبی کمتری داشته باشند، بتوانند برای هر نوع سرطان خون استفاده شوند و چندین CAR مجزا داشته باشند. برخی از این اشکال جدیدتر درمانهای CAR T-cell در حال حاضر در کارآزماییهای بالینی کوچک در حال مطالعه هستند.
علاوه بر این، آزمایشهای بالینی بزرگی در حال آزمایش درمانهای CAR T-Cell هستند که از سلولهای T جمعآوریشده از اهداکنندگان سالم به جای بیماران منفرد استفاده میکنند. با استفاده از سلولهای T اهدایی یا آلوژنیک، درمانهای CAR T-Cell میتوانند از قبل ساخته شوند و مانند سایر داروهای سرطانی، بلافاصله به عنوان درمانهای “آماده” برای هر بیمار در دسترس باشند، نه اینکه طی یک دوره چند هفتهای برای بیماران منفرد تولید شوند.
از آنجا که این روشهای درمانی CAR T-cell از سلولهای T اهدایی استفاده میکنند، به مهندسی ژنتیک بیشتری نیاز دارند تا از شناسایی سلولهای T به عنوان عامل خارجی توسط سیستم ایمنی بیماران و حمله به آنها جلوگیری شود.
محققان همچنین در حال بررسی استفاده از درمانهای CAR T-cell در مراحل اولیه درمان هستند، به جای اینکه آنها را تا زمانی که چندین درمان دیگر اثر خود را از دست ندادهاند، نگه دارند. کاربردهای تأیید شده دو درمان CAR T-cell در حال حاضر گسترش یافته است، به طوری که میتوان از آنها به عنوان درمانهای به اصطلاح خط دوم – یعنی پس از اینکه درمان اولیه یا خط اول اثر خود را از دست داده است – برای بزرگسالان مبتلا به برخی از سرطانهای خون استفاده کرد.
این رویکرد همچنین در کودکان در حال مطالعه است. به عنوان مثال، یک کارآزمایی بالینی، در حال آزمایش درمان با CAR T-Cell به عنوان درمان خط دوم در کودکانی است که به ALL سلول B “پرخطر” مبتلا هستند و شیمیدرمانی اولیه استاندارد پس از 6 ماه سرطان آنها را به طور کامل از بین نبرده است.
دکتر تری فرای، که رهبری آزمایشهای درمانی CAR T-cell را در بیمارستان کودکان کلرادو بر عهده داشته است، گفت: این کودکان معمولاً به مدت ۲.۵ سال شیمیدرمانی دریافت میکنند. در این آزمایش، به جای ادامه شیمیدرمانی که به نظر نمیرسد آنطور که انتظار میرفت مؤثر باشد، کودکان به درمان CAR T-cell منتقل میشوند.
دکتر فرای گفت بیمارانی که به خوبی پاسخ میدهند «ممکن است از دو سال دیگر شیمیدرمانی معاف شوند. فکر کردن به این موضوع شگفتانگیز است.»
تهیه و تنظیم: سید طه نوربخش
تأیید و نظارت: فائزه محمدهاشم-متخصص ژنتیک